서론
운동은 미토콘드리아의 생합성(biogenesis)을 증가시키는 주요 원인으로 제시되고 있으며, 이는 제2형 당뇨병(type II diabetes) 등 기타 대사 질환을 예방·치료하는 효과가 있다고 알려져 있다. 따라서 최근 운동 생리학 분야에서는 운동에 의한 미토콘드리아 생합성이 증가되는 현상을 과학적으로 규명하기 위한 시도가 계속되고 있다[1]. 일회성(acute or single bout) 운동이나 일상적(regular) 혹은 장기간(chronic)의 반복된 훈련(endurance training)은 골격근 내 미토콘드리아 생합성을 증가시키는 수많은 유전자(gene) 및 단백질의 증가를 수반한다[2].
운동은 미토콘드리아 생합성 증가를 조절하는 것으로 알려진 PPAR-γ co activator 1α (PGC-1α), mitochondria transcription factor A (Tfam) 그리고 Acetyl-CoA carboxylase (ACC)와 같은 핵 내 유전자를 발현시킬 뿐만 아니라, AMP kinase (AMPK)와 Sirtuin 같은 생리활성화 효소의 활성을 증가시켜, 미토콘드리아의 수와 크기를 증가시킨다[3]. 최근 Nitiric oxide (NO)가 미토콘드리아 생합성에 중요한 역할을 하고 있음이 보고되고 있는데, NO는 지방세포에서 미토콘드리아 생합성 관련 유전자의 증가에 기여할 뿐만 아니라, 골격근에서의 NO 생성이 glucose uptake와 미토콘드리아 생합성에 중요한 신호 전달 체계로서 제기되고 있다[4]. Cyclic guanosine monophosphate (cGMP)의 활성화는 NO 발생을 증가시키는 것으로 알려져 있으며, cGMP의 활성은 calcium binding protein과 calcineulin과 같은 calcium signal factor와 함께 미토콘드리아 생합성과 관련된 AMPK 신호기전을 조절하는 것으로 알려져 있다[5,6]. 그뿐만 아니라, 근수축으로 인한 endotherial nitric oxide synthase (eNOS)의 활성화는 미토콘드리아 생합성을 조절하는 중요 조절자로 보고되고 있다[7]. 그러나 현재까지의 연구는 근수축에 의한 NO의 발생이 미토콘드리아의 생합성에 중요한 변인임만을 증명하고 있으며, cGMP나 Ca2+ 관련 신호단백질과의 관련성에 대한 연구가 부족하여 운동을 통한 미토콘드리아 생합성의 정확한 신호전달체계에 대한 해석이 불명확한 실정이다.
골격근에 분포하고 있는 것으로 알려진 NOS는 neuronal NOS (nNOS), endothelial NOS (eNOS) 그리고 iducible NOS (iNOS)가 존재하는 것으로 알려져 있으며, 세포 내 L-arginine을 산소와 결합시킴으로써 산출물인 NO와 L-citruline을 생성하는 효소이다[4,8]. 또한 미토콘드리아에도 NOS가 존재(mtNOS)하며, 주로 eNOS가 골격근의 미토콘드리아에서 관찰된다[9]. NOS를 활성화시키는 세포 내 신호전달 체계는 다양하게 보고되고 있는데, Ca2+/Calmodulin complex, caveolin-1/3, HSP90 등과 같은 신호 단백질과 결합하거나, 세포 내 reactive oxygen species (ROS) 중의 하나인 H2O2와 같은 활성산소에 의해 NOS의 활성이 조절되는 것으로 알려져 있다[10,11]. 다양한 NOS 활성화 체계가 보고되고 있음에도 불구하고 운동에 의해 NOS가 발생되는 기전에 대해서는 명확하게 밝혀지지 않고 있는데, 최근 보고된 바에 의하면, eNOS가 knock out (KO)된 mice의 지방세포에서 지구성 훈련으로 인한 지방세포의 갈색화(browning) 효과가 나타나지 않음을 보고하고 있으며, 미토콘드리아 생합성 지표들도 유의하게 증가하지 않았음을 보고한 바 있다[12]. 이러한 결과는 지구성 훈련에 의한 NOS 활성화가 미토콘드리아 생합성을 조절할 수 있음을 제시하는 중요한 결과이다. 또한 S-nitroso-N-acetylpenicillamine (SNAP)과 같은 NO donor를 세포에 처리한 실험에서 미토콘드리아 생합성이 증가되며, mitochondrial DNA (mtDNA) 양의 증가와 함께 산화적인 인산화를 통한 ATP 생성이 활성화된다고 하였는데, 이러한 결과는 운동에 의한 NO의 증가가 미토콘드리아 생합성에 중요한 변인이 될 수 있음을 제시하고 있다[13,14].
골격근 수축 시 증가하는 세포 내 Ca2+은 Gene transcription과 세포 내 신호체계를 조절하는 중요 인자로 알려져 있으며, calcineurin, Ca2+/Calmodulin dependent protein kinase II (CaMKII) 그리고 Ca2+ dependent protein kinase C (PKC)와 같은 인자의 활성화는 미토콘드리아 생합성 및 산화적 인산화 능력의 향상을 가져온다[15-17]. 특히 CaMKII의 인산화는 운동을 통한 미토콘드리아 생합성 증가의 핵심적인 인자인 PGC-1α의 핵 내 이동을 증가시키며[18], PGC-1α는 미토콘드리아 생합성과 지방산 산화반응을 촉진하며, 골격근/심장근의 성장과 백색지방의 browning 반응을 조절하는 핵심인자로 알려져 있다[19]. 심장근에서의 β-adrenalergic 자극은 세포 내 Ca2+을 증가시켜, CaMKII의 활성을 증가시키는 것으로 보고되고 있는데, 이러한 신호과정은 이차적으로 NOS를 활성화하여, NO를 증가시키며, 근형질세망(sarcoplasmic reticulum, SR)에서의 Ca2+ 방출을 조절한다고 알려져 있다[20].
현재까지의 연구결과들은 NOS의 활성화 기전에 대해 세포 내 Ca2+ 신호전달 체계에 대한 고찰이 부족한 것이 사실이며, 특히 CaMKII와 같은 calcium binding protein에 의한 활성화 기전에 대한 연구결과가 부족한 실정이다. 또한 현재까지의 연구결과들은 몇몇 in vivo 실험을 통해 지구성 운동 시 NO 발생 억제를 통한 미토콘드리아 생합성 억제 효과만을 규명하였다. 따라서 본 연구자는 골격근 수축을 통해 증가하는 NO가 Ca2+ 신호체계에 의존적인지, Ca2+ binding protein에 의한 이차적 기전에 의해 조절되는지를 밝히기 위해, Ca2+ 신호체계 억제제와 Ca2+ binding protein kinase 억제제를 이용하여, 골격근 수축이 어떻게 NO 생성에 기여하는지를 규명하고자 하였으며, 골격근 수축에 의해 발현된 조절단백질에 의해 미토콘드리아 생합성과 관련된 여러 단백질과 mRNA의 증가가 어떠한 관계가 있는지를 규명하고자 하였다.
연구 방법
1. 연구 대상
이 연구에 사용된 실험동물은 출생 시기(8주령)가 동일한 C57BL/6 mice를 이용하였으며, mice는 J실험동물에서 구입하였다. 실험동물의 생육환경은 Specific-pathogen-free (SPF) system에서 12시간 주기의 명암과, 20˚C 그리고 습도는 40% 수준을 유지하였다. 모든 실험동물의 사육 및 실험은 Guide line for care and use of laboratory animal의 국제표준을 준수하였다. 동물실험과 관련된 연구윤리심의는 C 대학의 동물실험윤리위원회의 심사를 시행하였다(CBU 2014-00051).
2. 연구절차
1) Skeletal muscle primary cell (single fiber) 분리
골격근에서 single fiber를 분리하기 위해 각 실험동물은 경추 탈골을 실시하여, 비복근(gastrocnemius)을 적출하였다. 이 후 37˚C로 미리 준비된 0.2% type Ⅰ collagenase가 들어가 있는 Dulbecco’s Modified Eagle’s medium (DMEM) buffer에 적출된 골격근을 넣고 37˚C shaking water bath에서 2시간 동안 80-90 RPM으로 incubation하였다. 효소를 통한 분리가 끝나고 single fiber가 분리되면 single fiber가 포함된 DMEM buffer를 10% horse serum이 포함된 DMEM-FBS buffer가 포함된 Petri dish에 옮기고 37˚C CO2 incubator에서 overnight incubation을 실시하였다. 2일차에 Pasture pipette을 이용하여 single fiber를 분리하고 다시 37˚C CO2 incubator에서 overnight incubation을 실시하였다. 분리된 세포는 3일차에 실험에 이용되었으며, 실험 전까지 37˚C CO2 incubator에 보관하였다.
2) 골격근 primary cell의 전기자극(골격근 수축 simulation)
전기자극과 관련된 실험 프로토콜은 Park et al. [21]과 Liu et al. [22]이 이용한 방법을 사용하였다. Mouse에서 분리되어 DMEM medium buffer에 보관되어 있던 single fiber는 Krebs Ringer buffer (115 mM NaCl, 5.9 mM KCl, 1.2 mM MgCl2, 1.2 mM NaH2PO4, 1.2 mM Na2SO4, 2.5 mM CaCl2, 25 mM NaHCO3, 10 mM glucose, pH 7.4)로 옮겨지게 되고 1.5 mL 튜브 한 개당 muscle fiber를 15-20개씩 분주하였다. 37˚C 수조에서 5분 동안 안정을 취한 다음, 상온에서 carbon 소재의 전극을 사용하여, 전기자극기(DS2A mk2, Digitimer, England)로 자극을 실시하였다. 자극에 필요한 저주파 주파수는 10 Hz로 하고, 자극이 주어지는 시간은 1초, 자극 간 간격은 1초로 실시하였다. NO 측정 및 단백질 인산화 수준 변화 측정을 위한 전기자극의 지속시간은 300초를 기준으로 실시하였다.
3) Confocal micro scope를 이용한 골격근 세포에서의 NO 측정
전기자극에 의한 single fiber 수축 시 NO 발생량 측정은 DAF-FM (D-23841, Molecular probes, USA) 시약을 이용하여 측정하였다. CO2 incubator에 보관되어 있던 single fiber는 30-40개씩 Confocal dish로 분주되며, 10 μM의 DAF-FM이 포함된 DMEM Buffer로 교체된 후 약 30분 동안 incubation되었다. 이후 새로운 DMEM buffer를 이용하여, 세포 안에 흡수되지 않은 DAF-FM 시약이 제거되며, 이후 컨포컬 현미경(Confocal microscope, Nikon C1, Nikon, Japan)에서 전기자극을 실 시하면서 fluorescence 값을 측정하였다. 측정에 이용되는 excitation/emission 값은 495/515 nm를 사용하였다.
4) Single fiber에 사용된 Ca2+ 신호 억제제 및 Agonist 용량 및 용법
Single fiber 전기자극 시 사용된 Ca2+ 신호 억제제 및 Agonist 용량 및 용법은 다음과 같다. CamKII 억제제: autocamtimide-3-phosphate (AIP, 1mM, Sigma, USA). 일반적으로 처치 시간은 NO 측정 전 골격근 세포에 10-20분 정도 처치한 후 측정을 실시하였다.
5) nNOS/eNOS knock down을 위한 In vivo Electroporation
C57BL/6 mouse의 비복근에 nNOS/eNOS shRNA plasmid 100 μg (Santacruz, USA)을 100 μL Saline에 녹인 다음 인슐린 주사기를 이용하여, 뒷다리 비복근에 2-3회에 나누어 주사한 후 유전자 전기자극 전이기(electric pulse mediated gene transfer, Electro Square porator ECM 830, BTX, USA)를 이용하여 근육 속 핵으로 전이되도록 하였다. 동일한 방법으로 대조군 쥐에는 empty vector가 포함된 plasmid를 주입하였다. 이후 72시간 지난 후 실험을 실시하였다.
6) 일회성 treadmill 운동 후 근육 샘플 채취
연구에서 사용된 일회성 운동 강도는 Schefer와 Talan [23]의 연구를 참조하였으며, 10 m/min, 0˚에서 15분 동안 운동을 실시하였다. NO 측정에 필요한 근육 조직은 운동 직후에 적출하였으며, 미토콘드리아 생합성 관련 단백질 분석에 필요한 근육 조직은 운동 후 6시간에 적출하였다.
7) Protein 추출 및 Western blotting 분석
전기영동을 위한 muscle sample을 만들기 위해 적출된 비복근/primary cell에 lysis buffer (Roche, Germany)에 protease inhibitor (Roche, Germany)가 함유된 용액을 첨가하여 균질화기기로 분쇄한 다음 원심 분리(15,000 rpm)하여 상층액만 분리한 후 상층액을 대상으로 protein assay kit (Bio-rad, USA)과 spectrophotometer를 이용하여 단백질을 정량하였다(protein mg/mL). 정량화된 단백질은 primary antibody의 목표 분자량에 따라 각기 다른 농도의 SDS-polyacrylamide gel에서 전기영동분석기(Bio-rad minigel 3, Bio-rad, USA)를 이용하여 chromatography 방식으로 각각의 분자단위별로 분해하였다. 전기영동된 단백질은 Mini trans module (Bio-rad, USA)을 통해 PVDF membrane (Amersham, USA)에 전이되고, 단백질이 전이된 membrane은 1차적으로 3% Bovine serum albumin이 첨가된 PBS용액에서 1시간 동안 blocking 과정을 거친 후 일차 항체인 nNOS, eNOS, PGC-1α, Ac-lysine antibody (Santacruz, USA)가 1,000:1로 함유된 PBST용액에서 12시간 동안 반응시켰다. 이후 일차항체에서 반응된 membrane은 secondary antibody (Santacruz, USA)가 5,000:1로 첨가된 PBST에서 1시간 동안 반응된 다음, Bid Rad chemidoc XRS (Bio-rad, USA) 장비와 ECL detection regent (Amersham, USA)를 이용하여 immuno reactive band의 상대적 발광도를 측정하여 정량화하였다.
연구 결과
1. 골격근 세포(single fiber)에서 근수축 시 각 NOS의 억제에 따른 NO 생성 및 미토콘드리아 생합성 인자의 변화
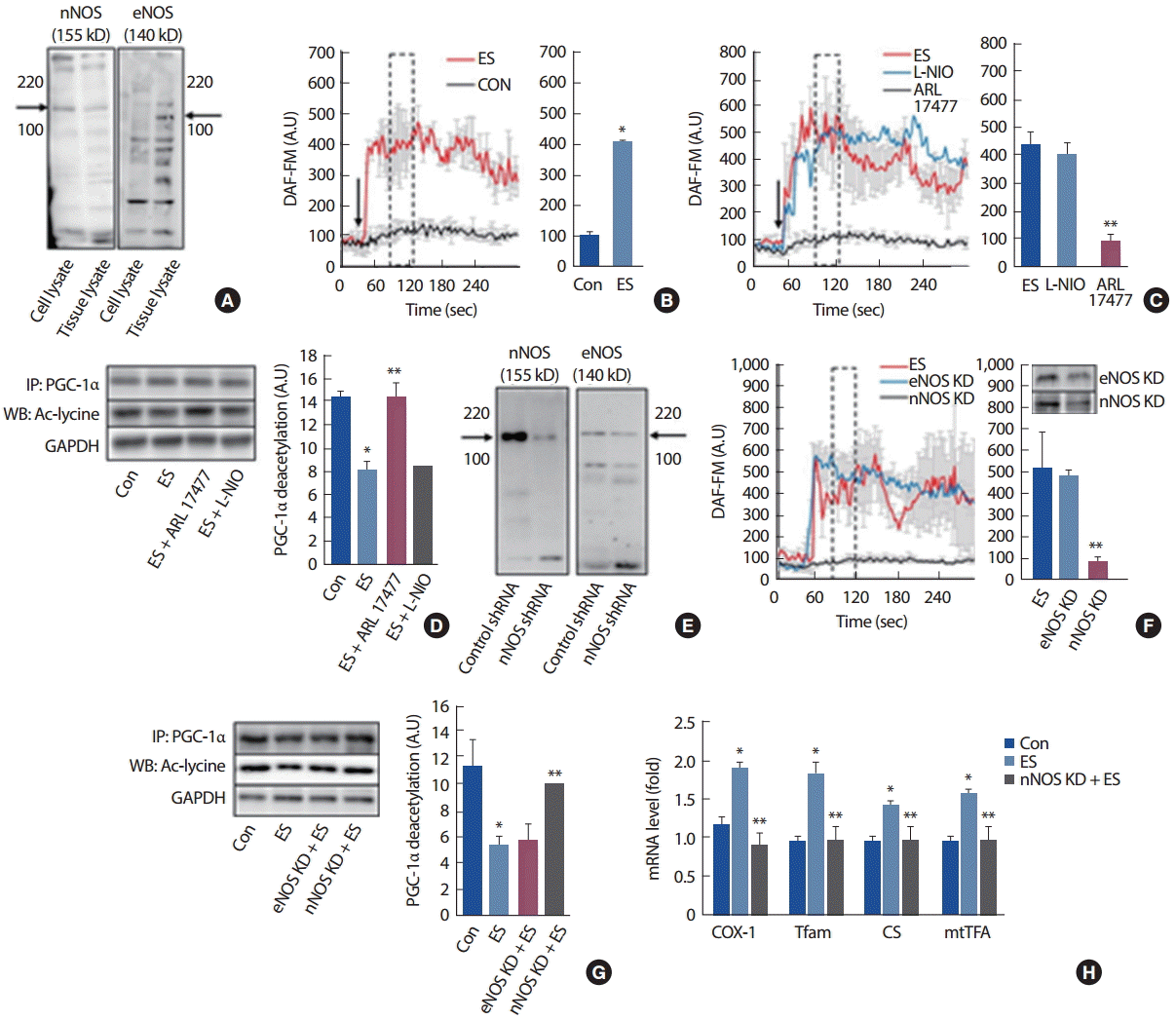
Single fiber 및 골격근 조직에 nNOS의 eNOS이 발현되어 있다고 알려져 있으므로 각각의 발현 정도를 비교한 결과, nNOS의 경우, single fiber 및 조직의 lysate에서 모두 발현됨을 확인한 반면, eNOS의 경우 single fiber에서는 발현량이 극히 적음을 확인할 수 있었다(Fig. 1A). 전기자극에 의한 single fiber 수축 시 NOS에 의해 세포 내 NO가 증가하는 것을 확인하기 위해 NO detection dye인 DAF-FM을 이용하여 측정한 결과, 전기자극에 의해 single fiber의 NO가 유의하게 증가하는 것으로 나타났다(Fig. 1B). Fig. 1A에서 single fiber에서 nNOS 및 eNOS가 발현됨을 확인하였으므로 각각의 NOS 억제제를 사용하였다. 전기자극을 이용한 single fiber 수축에 따른 NO 발생을 비교한 결과, nNOS 억제제인 ARL 17477에 의해 NO의 생성량이 유의하게 감소한 반면 eNOS 억제제인 L-NIO에 의해서는 유의하게 감소되지 않았다(Fig. 1C). 이러한 결과는 single fiber 수준에서 수축 시 nNOS가 NO 발생에 주로 기여하고 있음을 제시하고 있다. 이후 NOS 억제제가 미토콘드리아 생합성 지표인 PGC-1α의 deacetylation에 어떠한 영향을 미치는지를 관찰하였는데, 각 NOS 억제제를 사용한 NO 생성 결과와 비슷하게 nNOS 억제제를 사용한 single fiber에서 PGC-1α의 deacetylation이 유의하게 억제됨을 확인하였다(Fig 1D). 각 NOS의 억제제는 비지향성 side effect가 존재할 수 있으므로 single fiber에 각각의 NOS에 대한 shRNA를 이용하여 각각의 NOS에 대한 gene knock down 실험을 실시하였으며, 각 NOS 발현이 유의하게 감소되는 것을 확인하였다(Fig. 1E). nNOS/eNOS가 knock down (KD)된 single fiber를 이용하여 근수축에 의한 NO 생성을 비교하였으며, NOS 억제제를 사용한 결과와 유의한 경향으로 nNOS의 KD이 single fiber 수축에 의한 NO 생성을 억제한 반면, eNOS의 KD은 수축으로 인한 NO 생성을 억제하지 못하였다(Fig. 1F). 또한 nNOS/eNOS가 KD된 single fiber를 이용하여, PGC-1α의 deacetylation을 측정한 결과, nNOS KD 세포에서 유의한 감소가 나타나는 것을 확인하였으며(Fig. 1G), nNOS KD 세포는 single fiber 수축에 의한 미토콘드리아 생합성 관련 gene의 mRNA 수준이 유의하게 감소하는 것을 관찰하였다(Fig. 1H). 이러한 결과는 근세포에서 근수축 시 nNOS가 NO를 생성하는 중요 조절자임을 제시하고 있으며, 근수축으로 인한 NO의 생성이 미토콘드리아 생합성 조절자로 알려진 PGC-1α의 deacetylation을 조절하는 중요 신호기전임을 제시하고 있다.
2. Single fiber 수축 시 CaMKII 억제에 따른 NO 생성 및 미토콘드리아 생합성 인자의 변화
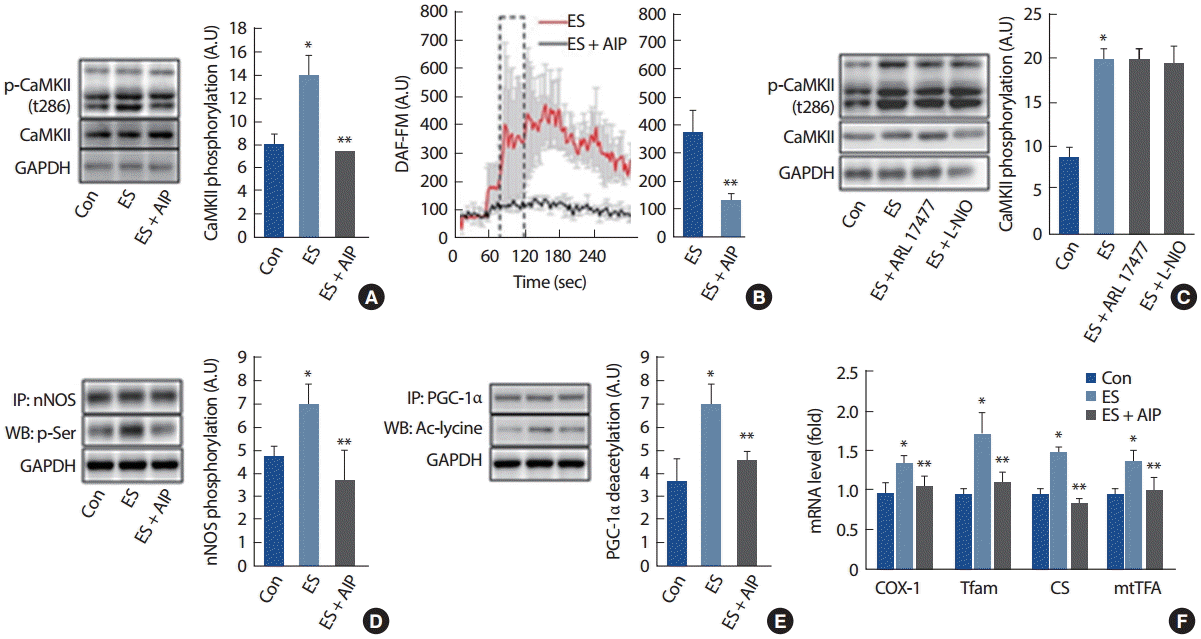
골격근 수축 시 근세포에서의 Ca2+의 증가는 CaMKII의 인산화 증가를 가져온다고 알려져 있으므로 single fiber에서 근수축 시 CaMKII의 인산화를 측정하였으며, CaMKII의 억제제인 Autocamtide-2 inhibitory peptide (AIP)의 효과를 규명한 결과, 근수축에 의해 CaMKII의 인산화가 유의하게 증가하는 반면, AIP에 의해 유의하게 감소하는 것을 확인하였다(Fig. 2A). CaMKII가 근수축 시 NO 생성에 어떠한 영향을 미치는지를 규명하기 위해 근수축 시 AIP를 처치하여 NO 생성을 비교하였으며, CaMKII 억제제인 AIP는 근수축에 의한 NO 생성을 유의하게 억제하는 것으로 나타났다(Fig. 2B). CaKMII가 NOS에 의해 조절되는지를 규명하기 위해 각각의 NOS 억제제를 전처리하였으며, 골격근 수축에 따른 CaMKII의 인산화를 비교하였다. 실험결과, 근수축에 의한 CaMKII의 인산화 증가는 NOS 억제제에 의해 감소하지 않는 것으로 나타났다(Fig. 2C). 이러한 결과는 NOS에 의한 NO 생성 기전보다 CaMKII에 의한 신호기전이 보다 상위에 있음을 나타나고 있으며, CaMKII가 근수축 시 NOS를 조절하는 중요조절자임을 제시하고 있다. CaMKII가 NOS에 어떠한 영향을 미치는지를 규명하기 위해, nNOS를 이용한 immunoprecipitation (IP) 실험을 실시하였으며, serine 인산화를 비교하였다. 실험결과 CaMKII 억제제는 근수축에 의한 nNOS의 serine 인산화를 억제하는 것으로 나타났으며, 이러한 결과는 CaMKII에 의한 nNOS 인산화 조절 신호기전이 근수축에 의한 NO 발생체계에 중요한 변인임을 제시하고 있다. 또한 AIP는 근수축에 의한 PGC-1α의 deacetylatoion과 미토콘드리아 생합성 관련 mRNA의 발현 또한 억제하는 것으로 나타났다(Fig. 2E,F).
3. In vivo 모델에서 트레드밀 운동 시 nNOS/eNOS Knockdown에 의한 미토콘드리아 생합성 지표의 변화
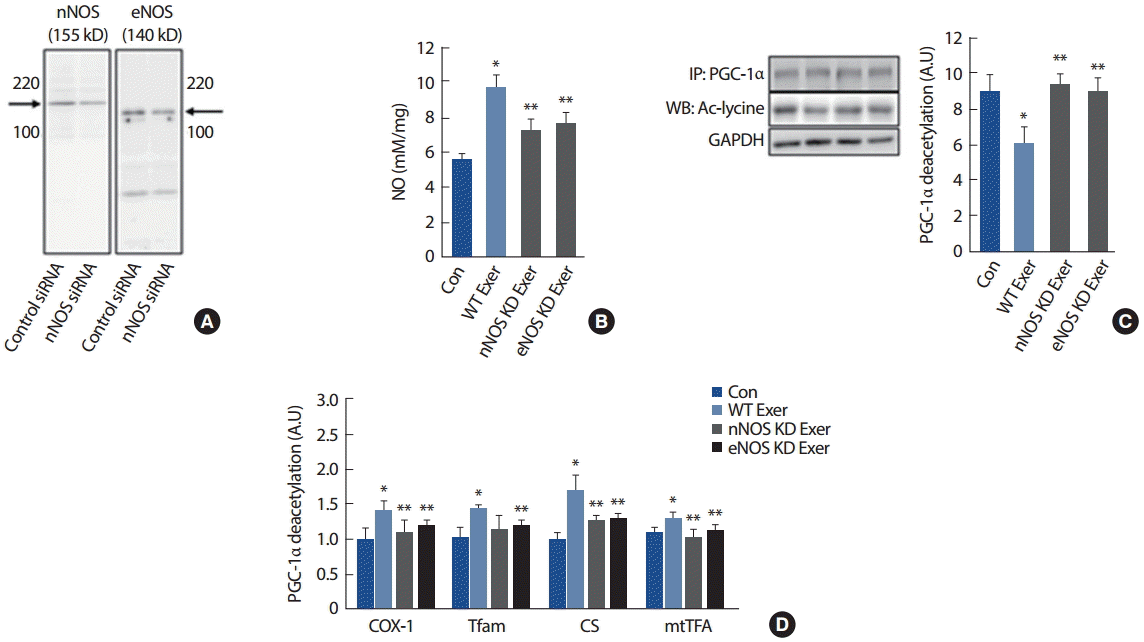
근세포에서 근수축 시 nNOS가 NO 생성을 조절하는 중요인자임을 알았으며, 이를 CaMKII가 조절하고 있음을 확인하였으므로 in vivo 모델을 이용하여 검증을 실시하였다. 각각의 mice의 gastrocnemius muscle (GM)에 siRNA를 이용하여, in vivo electroporation을 실시하였으며, 골격근 조직에서 nNOS 및 eNOS의 유의한 감소를 확인할 수 있었다(Fig. 3A). 트레드밀 달리기(treadmill running)를 10 m/min, 0°에서 15분 동안 실시한 결과, 각각의 NOS가 KD된 조직에서 NO를 측정하였다. 실험결과, 운동군에 비해 nNOS 및 eNOS KD군 모두에서 NO 생성이 억제되는 것을 확인하였다(Fig. 3B). 이러한 결과는 in vivo 실험의 경우 골격근 수축 시 nNOS 및 eNOS가 동시에 NO생성에 관여하고 있음을 제시하고 있다. 또한 이들 조직을 이용한 PGC-1α의 deacetylation 실험과 미토콘드리아 생합성 관련 mRNA의 변화에서도 nNOS 및 eNOS KD군에서 유의한 감소가 나타나는 것으로 나타났다. 이러한 결과는 in vivo 실험에서와 같이 조직수준의 경우 nNOS 및 eNOS가 동시에 관여되어 있음을 제시하고 있다.
논의
운동은 골격근 수축을 지속하기 위한 대사체계를 활성화시키며, 이는 다양한 세포 내 신호체계를 활성화시킨다. 반복적인 운동은 골격근 세포 내의 단백질 동화작용을 촉진시키며, 미토콘드리아 크기와 수의 증가로 대표되는 미토콘드리아 생합성 증가의 원인이 된다[24,25]. 본 연구에서는 미토콘드리아 생합성에 중요한 역할을 하는 것으로 알려진 NOS의 활성화 과정에서 CaMKII의 활성화가 중요한 역할을 하고 있음을 관찰하였으며, 특히 CaMKII로 인한 nNOS의 인산화가 골격근 수축을 통한 NO 생성 과정을 조절하고 있음을 확인하였다. 이러한 결과와 함께, CaMKII에 의한 NO 생성은 미토콘드리아 생합성 증가지표인 PGC-1α의 deacetylation을 조절함을 확인하였으며, 결국 in vivo 및 in vitro 실험을 통해 세포와 조직수준에서의 미토콘드리아 생합성 관련 지표의 조절기능을 하고 있음을 밝히고 있다.
골격근에는 3가지 종류의 NOS가 혼재되어 있음이 보고되고 있다. Neuronal NOS (nNOS, NOS1), endothelial NOS (eNOS, NOS3) 그리고 inducible NOS (iNOS, NOS2)가 있으며, 골격근 조직에 nNOS/eNOS가 일반적으로 발현되어 있는데 반해, iNOS는 type 2 diabetes이나 대사이상 등의 염증반응에 의해 특이적으로 증가하는 것으로 알려져 있다[26,27]. 본 연구에서는 골격근에서 NO 생성 기전을 확인하기 위하여 in vitro적으로 골격근에서 single fiber를 분리하여 근수축을 통한 신호기전과 in vivo에서 운동 모델을 이용하였다. 특히 nNOS와 eNOS를 세포수준과 조직수준에서 비교한 결과(Fig. 1A), primary cell에서는 nNOS가 주로 발현되어 있음을 확인하였으며, 전기자극을 통한 근세포 수축 시 NO 발생기전이 nNOS에 의해 주로 조절됨을 nNOS의 억제제 및 단백질 knock down 실험을 통해 알 수 있었다(Fig. 1C-F). 골격근 세포에서 nNOS는 plasma membrane을 이루고 있는 dystrophin associated glycoprotein complex를 이루고 있는 α-syntrophin과 결합되어 있다고 알려져 있다[28]. 근절 부분의 nNOS는 특히 type II 근세사에서 많이 나타나는 것으로 알려져 있으며, 운동 시 혈관 상피세포(endothelial cell)의 eNOS와 함께 NO 생성을 동반 상승시키는 효과를 가져옴으로써 혈류 증가와 골격근 수축을 위한 대사활성화에 기여한다[29]. 본 연구에서는 골격근 세포를 분리하여 실험을 실시한 결과, nNOS가 골격근 세포수준에서 주로 발현되어 있으며, 조직수준에서는 nNOS/eNOS가 동시에 발현되어 있음을 확인하였는데, 이는 조직수준의 경우 혈관내피세포를 포함하고 있기 때문으로 생각된다. 그러나 Tengen et al. [30]에 의하면 골격근 세포의 미토콘드리아와 eNOS가 co-expression되어 있음을 제시하고 있으며, Bates et al. [31]에 의하면 미토콘드리아 eNOS를 mtNOS라고 명명하며, eNOS와 많은 homology를 가지고 있다고 하였다. 본 연구에서 eNOS는 Fig. 1E에서와 같이 근세포에서 eNOS를 knock down 실험을 실시한 결과, 골격근 수축으로 인한 NO 생성과 미토콘드리아 생합성 지표의 유의한 감소를 나타내지 않았는데, 차후 mtNOS를 knock down 실험을 통해 골격근 수축에 의한 eNOS homology가 높은 NOS의 기능에 대해 연구할 필요가 있다고 생각된다. 그러나 실제 in vivo 연구에서는 nNOS와 eNOS의 knock down 모두에서 유의한 NO 생성 감소와 미토콘드리아 생합성 지표의 감소를 보였다(Fig. 3). 조직수준에서 NO의 생성은 상피세포, 면역세포, 신경세포 그리고 조혈모세포 등의 복합적인 영향에 의해 조절되며[32], 운동으로 수반되는 혈관확장 등의 다양한 영향을 받는다[33]. In vivo 실험에서 NO 억제제인 L-NAME을 처치하면, 운동으로 인한 혈관확장과 미토콘드리아 생합성이 감소하게 되는데, 이는 운동에 의한 조직수준의 NO 생성이 중요한 요인임을 제시하고 있다[34,35]. 이러한 결과는 운동으로 인한 미토콘드리아 생합성 조절기전에 있어 NO 생성이 중요한 역할을 하고 있음을 제시하고 있지만, 운동 시 조직수준에서의 NO 생성은 보다 복잡한 신호기전을 통해 조절될 수 있음을 제시하고 있다. 따라서 본 연구에서 실시한 electroporation 방법을 이용한 실험은 조직수준의 nNOS/eNOS를 모두 감소시켰을 것임으로 골격근 세포 수준에서 knock down 효과에 의해 조절되었기보다는 골격근 조직 내의 다양한 세포에서 발현 감소로 인한 결과가 나타난 것으로 생각된다.
NOS 자체 효소활성을 조절하는 기전에 있어 중요한 신호전달 물질은 cyclic GMP (cGMP)로 알려져 있으며, 세포 내 cGMP의 수준은 세포 내 Ca2+ 신호기전 및 다양한 부속단백질에 의해 조절됨이 제시되고 있다[36]. CaMKII는 Ca2+ 의존성 protein kinase의 하나로 다양한 세포 내 단백질을 인산화하는 중요단백질이며, 세포 내 Ca2+ 신호의 크기와 빈도에 의해 조절되는 것으로 알려져 있다[37]. CaMKII는 미토콘드리아 생합성을 조절하는 중요인자이며, 골격근 수축, high fat diet 등에 의한 세포 신호 전달에 의해 autophosphorylation되어 활성화되어 Tfam, PGC-1α과 같은 미토콘드리아 생합성 관련 gene transcription을 조절하는 중요 변인이 된다[38].
본 연구에서는 세포수준에서 근수축과 함께 CaMKII의 인산화가 증가하였으며(Fig. 2A), CaMKII 억제제인 AIP를 사용한 결과, NO 생성이 억제되는 반면, NO 억제제는 근수축으로 인한 CaMKII의 인산화를 억제하지 못하였다. 이러한 결과는 CaMKII가 NOS의 조절자가 될 수 있는 결과를 제시하고 있다. 이러한 현상과 관련된 많은 연구결과는 보고된 바 없으나, 신경세포의 허혈 상태(ischemia)에서 CaMKII는 nNOS의 serine (s847) residue 인산화를 조절하는 중요 조절자로 알려져 있다[39]. 또한 뇌하수체(pituitary) 암세포(cancer)의 경우, CaMKII를 억제하게 되면, nNOS의 Ser1412의 인산화가 억제되어 NO 생성이 감소함도 보고되고 있다[40]. 이러한 결과는 운동에 의한 CaMKII활성의 증가가 nNOS의 인산화를 조절함으로써 NO 생성을 조절할 수 있음을 제시하고 있다. 본 연구에서도 근수축 시 nNOS의 Serine residue 인산화가 CaMKII 억제제에 의해 조절됨을 확인하였으며(Fig. 2D), 이러한 NOS 인산화의 억제는 미토콘드리아 생합성 지표의 감소를 가져왔다. 따라서 운동으로 인한 CaMKII의 인산화는 골격근 내 NO를 조절하는 중요기전임을 확인하였으며, 미토콘드리아 생합성 조절에 중요한 기전임을 알 수 있었다[18].
그러나 골격근 수축 시 증가하는 세포 내 Ca2+은 CaMKII 이외에도 calcineulin, protein kinase C (PKC) 등의 다양한 Ca2+ dependent enzyme의 활성을 증가시키는 요인이며, 이들 인자도 골격근의 수축 및 운동에 증가하여 미토콘드리아 생합성을 조절하는 중요인자가 될 수 있다[41,42]. 본 연구에서는 CaMKII의 억제가 골격근 수축에 따른 NOS의 인산화와 미토콘드리아 생합성 지표의 변화를 확인하였을 뿐, 운동에 의해 증가되는 단백질의 발현 경향에 대해서는 확인하지 못하였으므로 차후 연구를 통해 다른 Ca2+ dependent protein kinase와의 연관성도 추가로 규명되어야 할 것으로 생각된다.
결론
당뇨, 고혈압 등의 대사질환을 완화하는 운동의 효과를 운동생리학적으로 규명하는 데 있어 많은 연구들이 진행 중이다. 본 연구에서는 미토콘드리아 생합성 지표를 조절하는 것으로 알려진 NO의 생성 기전에 대해 규명하려고 하였으며, CamKII가 중요한 역할을 하고 있음을 제시하고 있다. 이러한 결과는 운동으로 인한 미토콘드리아 생합성 증가의 조절기전을 규명하는 데 과학적 근거를 제공할 수 있을 것으로 생각된다.
세포수준과 조직수준에서 nNOS/eNOS의 발현을 비교한 결과, 세포수준에서는 nNOS가 주로 발현되어 있는 것을 확인하였다. 골격근 수축 시 nNOS 억제제 및 nNOS 단백질 knock down은 골격근 수축으로 인한 NO 생성 및 미토콘드리아 생합성을 유의하게 억제한 반면, eNOS 억제제 및 eNOS 단백질 knock down은 억제하지 못하였다. 반면 조직수준에서 nNOS/eNOS 단백질을 knock down한 결과 운동으로 인한 NO생성 및 미토콘드리아 생합성 지표의 유의한 감소를 가져왔다. 골격근 수축으로 인한 NO의 생성기전에서 CaMKII의 억제는 nNOS의 인산화와 미토콘드리아 생합성 지표를 감소시키는 중요원인이 됨을 확인하였다. 이러한 결과는 세포수준에서 골격근 수축에 의한 CaMKII의 활성 증가가 NOS를 통한 NO 생성을 조절하는 중요기전임을 제시하고 있으며, 조직수준에서 NO 생성 및 미토콘드리아 생합성 증가 기전은 보다 복잡한 기전에 의해 조절되고 있음을 제시하고 있다.