AbstractPURPOSE: The purpose of this study was to identify spatial distribution of type I myosin heavy chain among different muscle fibers by endurance exercise for 8 week.
METHODS: The animal were trained for 8 week a on treadmill. To avoid acute exercise effect of training, Tibialis anterior (TA) muscles were dissected 18 hours after the last bout of exercise. To evaluate different type myosin heavy chain and mitochondria expression, we performed themulticolor immunofluorescence analysis and western-blotting.
RESULTS: Type IIb and IIx fiber in the 8-week trained group decreased trained skeletal muscle for 8 weeks were decreased 46% and 51% respectively than the sedentary group. Type IIa and I in the 8-week trained group increased 2.2 and 1.7 folds respectively than the sedentary group. ATP synthase, cytochrome C, NADH and SERCA2a in the 8-week trained increased 2.5, 2.2, 2.8, and 2.5 folds respectively than the sedentary group. TA muscles showed increased in the hybrid fiber type distribution. Type I and lla MHC increased at all type II fiber the trained group than the sedentary group.
서론지구성 운동 트레이닝이 백근섬유(type II)의 속성을 적근섬유(type I)의 속성으로 변화시킬 수 있는가? 이에 대한 관심과 연구는 1960년 근섬유의 수축 속성의 변화를 살펴보기 위한 cross-reinnervation 연구[1] 후부터 현재까지 진행되고 있으나 속근에서 지근으로 섬유 유형의 전환에 관련된 문제는 여전히 결론을 내리지 못하고 있다. 지구성 운동 트레이닝은 미토콘드리아의 수와 크기 증가, 원활한 산소 공급 능력의 증가 또는 근 피로의 저항성 증가 등을 통해서 지구력을 향상시키며[2,3], 근섬유의 속성에 따라서 미토콘드리아 함량, 대사 특성 및 피로에 대한 저항성도 차이가 있다[4]. 따라서 지구성 운동 트레이닝과 근섬유 형태 변화는 관련이 있다. 일반적으로 지구성 운동에 대한 적응과정에 의해서 근섬유 속성이 보다 산화적인 특성으로 변화된다는 것은 잘 알려져 있다. 그러나 이는 IIb가 IIx로 또는 IIx가 IIa로 전환되는 것이며[5-7], II형 섬유가 I형 섬유로 전환되는 것에 대한 의견은 서로 일치되지 않고 있다[6,8-18].
최근 2개의 myosin heavy chain (MHC) 아형을 가지고 있는 혼합형 (hybrid) 근섬유가 보고되었다[19,20]. 이는 근섬유의 형태가 IIb, IIx, IIa형 또는 I형 섬유로 구분되는 것이 아니라 2개 이상의 MHC가 서로 다른 비율로 혼합되어 연속적 무한대(스펙트럼)의 근섬유 형태가 존재할 수 있음을 의미한다. 과거 흰색과 검은색으로 표현되던 섬유 유형에서 회색이 발견된 것처럼 흰색과 검은색 사이에 연속적으로 무수한 회색이 존재할 가능성이 있다.
근섬유를 확인하기 위해 다양한 방법(pH 수준에 따른 ATPase 활성 분석, 전기영동(electrophoretic) 그리고 특이적 MHC 아형에 대응하는 항체를 이용한 immunohistochemical analysis)이 활용되고 있다[21,22]. Myosin ATPase를 이용한 근섬유 속성을 구분하기 위해서는 각각의 다른 section에서 최소 2회 이상의 다른 pH로 사전 배양(preincubation) 이 수행되어야 하는데[23,24], 이러한 방법으로는 하나의 근섬유에서 혼합된 MHC 아형을 확인할 수 없다. 최근 immunofluorescence 방법을 이용한 골격근 MHC를 확인하는 연구에서 하나의 근섬유에서 hybrid MHC 아형이 보고되었으며[22], 이를 이용한 방법은 지구성 운동에 의한 근섬유의 속성 변화가 산화적 hybrid 근섬유를 증가시키는지 또는 type II가 type I 근섬유로 전환되는지 확인할 수 있을 것이다.
근 단면에서 섬유의 대사적 분류 없이 MHC 유형을 확인하는 방법으로부터 대사적 섬유 형태를 결정하는 것은 부적절한 해석을 유도할 수 있다. 예를 들어, 척추 상해 후에 IIx 섬유 퍼센트는 크게 증가하지만 산화적 대사를 나타내는 섬유 형태의 지표인 succinate dehydrogenase도 함께 증가한다. 즉 속근섬유의 비율이 증가하였다고 하여 산화적 근섬유가 감소했다고 해석하는 것은 부적절하다[24]. 근섬유 내에는 연속적인 대사 스펙트럼이 존재하며[25], 미토콘드리아 생합성과 근섬유 형성은 각각 별개의 과정을 거쳐 생성되기 때문에[26], 근섬유의 형태를 확인하기 위해서는 섬유의 대사적 속성도 함께 분석되어야 한다. 또한 명확하게 근섬유의 유형을 분석하기 위해서는 골격근의 수축 속도도 분석되어야 하는데, 수축 속도 연구와 MHC 및 대사속성 연구를 병행할 수 없는 연구문제(근 수축 속도 측정 후 좌업군의 운동 효과를 제거하기 위한 휴식기가 운동군의 운동효과를 감소시킬 수 있음)와 실험동물 및 연구기간이 추가되어야 하는 문제로서 본 연구에서는 골격근 수축 속도와 관련된 sarco/endoplasmic reticulum Ca2+-ATPase (SERCA)2a를 분석하여 이를 대신하였다.
따라서 본 연구는 장기간 지구성 운동에 대한 적응으로 근섬유 형태의 변화가 다양하게 또는 스펙트럼 형태의 진행과정을 거치는지 확인하기 위해서 immunofluorecence와 immunoblotting을 이용한 MHC 유형과 미토콘드리아 수준 및 SERCA2a를 확인하였다.
연구 방법1. 실험동물실험동물은 6주령된 12마리의 수컷 C57BL/6J 생쥐(mouse)이며, 대상들은 1주일의 환경 적응을 실시한 후 무작위로 좌업 그룹(sedentary, SED)과 8주 지구성 운동 그룹(exercise, EX)으로 분류하였다.
3. 사육 환경실험동물은 한 우리에 3마리씩 넣어 사육하였으며, 일반식이(Purina, USA)를 물과 함께 자유롭게 섭취하도록 하였다. 명기(06:00-18:00)와 암기는 각각 12시간, 사육실 온도는 21℃로 자동 유지 및 조절될 수 있도록 하였다.
4. 근육 샘플 준비생쥐의 Tibialis anterior(TA)는 99% 이상이 type II 근섬유로 구성되어 있으므로[22], 지구성 운동에 의한 type II 섬유가 type I 섬유로 변화하는 과정을 확인하기 용이하다. 실험이 완료된 대상의 TA 근육을 적출하여 O.C.T. compound (Tissue-Tek, USA) 속에 완전히 묻히게 넣었다. 액체 질소로 온도를 감소시킨 isopantane으로 근육을 동결시킨 후 -80℃에 보관하였다. 근육은 -20℃가 유지되는 cryostat (Thermo Electronic, USA)으로 근육을 10 μm의 두께로 cryosections하여 유리슬라이드(slide)에 부착하였다. Cryosection 후 나머지 근육은 immunoblotting 샘플로 사용하기 위하여 -80℃에 보관하였다.
5. ImmunofluorescenceMulticolor immunofluorescence 방법은 Bloemberg & Quadrilatero의 방법[22]을 참고하였다. Cryosection하여 슬라이드에 부착된 근육을 상온에서 30분 말린 후 PBS를 이용하여 10%로 희석시킨 goat serum으로 한 시간 blocking하였다. 1차 항체 혼합물(cocktail)을 상온에서 1시간 배양 후 3회 PBS로 세척하였다. 1차 항체 MHC I (BA-F8), MHCIIa (SC-71), MHCIIx (6H1), MHCIIb (BF-F32)는 Developmental Studies Hybridoma Bank (University of Iowa, USA)에서 구매하였다. 2차 항체 Alexa Fluor 350 IgG2b (blue), Alexa Fluor 488 IgG1 (green) 그리고 Alexa Fluor 555 IgM (red)을 Thermofisher (USA)에서 구매하여 이용하였으며, 1시간 배양 후 PBS로 3회 세척하였다. Prolong Gold antifade reagent (Thermofisher, USA)를 근육 슬라이드 위에 도포한 후 coverslip을 덮었다.
슬라이드는 Nikon eclipse te2000-u (Nikon, USA)와 X-Cite 120 PC(Excelitas, USA)를 이용하여 가시화되었으며, 현미경은 적색(Excitation BP 545/25 nm; Emission BP 605/70 nm), 녹색(Excitation BP 470/40 nm; Emission BP 525/50 nm), 청색(Excitation BP 365/12 nm; Emission LP 397 nm) 필터가 장착되어 있다. 이미지는 MetaMorph 소프트웨어(Molecular devices, USA)를 이용하여 획득되었다.
6. Western blotting동결된 근육은 막자사발을 이용하여 분말로 만들고 lysis buffer [27]를 이용하여 균질화하였다. 균질화된 시료는 미토콘드리아를 파괴하기 위하여 동결과 해동 과정을 3회 반복하였으며, 원심분리(1,500 ×g, 4℃)하여 상층액을 사용하였다[28]. 단백질 농도는 Lowry et al. [29]의 방법으로 측정하였다.
시료가 동일한 단백질 농도가 되도록 lysis buffer를 이용하여 희석하였으며, laemmli sample buffer를 첨가한 후 5분간 100℃ 물에 가열하여 용해하였다. 준비된 시료는 SDS-polyacrylamide gel을 이용하여 전기영동하였으며, 단백질을 nitrocellulose membrane에 전이(transfer)시킨 후 Membrane은 다음의 일차항체와 함께 이튿날까지 배양하였다[28]. MHC 1차 항체는 immunofluorescences에서 이용된 것과 동일한 것을 이용하였으며, ATP synthase (ATP synth, invitrogen, USA), NADH ubiquinone oxidoreductase (NADH, invitrogen, USA), cytochrome C (CYTO C, BD Biosciencesm USA), sarco/endoplasmic reticulum Ca2+-ATPase 2a (SERCA2a, cell signalling, USA). 이차항체는 Horseradish peroxidase (HRP)-conjugated donkey anti-rabbit IgG (SERCA2a), PGC-1α과 donkey anti-mouse IgG (MHC I, IIa, IIx, IIb, β-actin)은 Jackson ImmunoResearch Laboratories (USA)에서 구매하였다. 각각의 항체가 결합된 단백질의 시각화를 위하여 ECL kit (Sigma, USA)를 이용하였다[28].
연구 결과1. 8주간 지구성 운동 트레이닝이 MHC와 미토콘드리아 및 SERCA2a의 발현에 미치는 영향8주간 지구성 트레드밀 훈련을 실시한 생쥐의 TA 근육에서 MHC와 미토콘드리아 단백질 발현 양상을 살펴본 결과는 Fig. 1과 같다.
트레드밀 훈련을 실시한 생쥐의 TA 근육에서 type IIb와 IIx는 대조군보다 각각 46% (p<.01)와 57% (p<.01) 감소하였다. 트레드밀 훈련을 실시한 생쥐의 TA 근육에서 type IIa와 I은 대조군보다 각각 2.2배(p<.01)와 1.7배(p<.05) 증가하였다(Fig. 1A).
트레드밀 훈련을 실시한 생쥐의 TA 근육에서 ATP synthase, CYTO C, NADH 그리고 SERCA2a는 대조군보다 각각 2.5배(p<.001), 2.2배(p<.01) 및 2.8배(p<.001), 2.5배(p<.01) 증가하였다(Fig. 2B).
2. 8주간 지구성 운동 트레이닝 후 Immunofluorescence 기법을 활용한 MHC 발현논의골격근은 활동양상에 따라 수축 및 대사속성을 변화시킬 수 있다. 일반적으로 골격근은 type I (느린 수축, 산화적 대사), type IIa (빠른 수축, 산화 및 해당성 대사), type IIx (빠른 수축, 해당성 대사) 그리고 type IIb (매우 빠른 수축, creatine phosphate 및 해당성 대사, 인간에서는 발견되지 않음)로 구분된다[20]. 그러나 하나의 근섬유가 하나의 MHC 아형만 함유하고 있는지에 대한 의문이 제기되어 왔으며, 2개 이상의 MHC 아형을 함유하고 있을 가능성도 제시되었다[30,31]. 섬유의 대사적 속성뿐만 아니라 수축 스피드에도 아주 느림에서 아주 빠름까지 연속적 무한대가 존재하는 것처럼 하나의 근섬유에 2개 이상의 MHC 아형이 서로 다른 비율로 혼합되어 다양한 또는 무수한 형태의 근섬유가 존재할 가능성이 있다. 최근 Immunoflourescence 기법을 통한 연구에서 MHC 아형의 혼합된(hybrid) 형태가 보고되었으며[22], 본 연구의 좌업 및 운동군 골격근에서 MHC 아형들의 혼합된 형태를 확인할 수 있었다(Fig. 2B). 즉 과거 pH 농도에 따른 ATPase 염색 방법은 우세한 MHC 아형만 나타나게 됨으로써 MHC 아형의 혼합된 형태는 확인할 수 없었다.
운동 트레이닝이 골격근 섬유 유형을 전환시킬 수 있는가에 대한 많은 연구가 진행되어왔다. 트레이닝되지 않은 골격근의 속근(type IIa와 IIb)과 지근(type I) 간에 비율은 50/50이지만, 높은 유산소 및 지구력을 요하는 스포츠 선수들은 지근 섬유의 비율이 90-95%인 반면 높은 무산소성 대사 능력, 근력 및 파워가 요구되는 운동선수들(예; weight lifting and sprinting)은 속근섬유의 비율이 60-80% 수준인 것으로 나타났다[32,33]. 이러한 운동선수들의 종목 특성에 따른 근섬유의 비율이 트레이닝에 의한 것인지에 대한 의문은 매우 중요한 연구 목표 중 하나였으며, 연구들은 트레이닝이 type II 섬유 유형 간 변화를 증명하였다. 그러나 type II와 I 섬유 유형 간 전환에 대한 연구결과는 전환되지 않는다[6,8,10-12]와 전환이 가능하다는 연구 결과들[13-18]로 논쟁의 여지가 남아있다.
본 연구의 결과는 8주간 지구성 운동 트레이닝에 의하여 생쥐의 골격근 type IIb와 IIx MHC가 감소하며, 속근섬유이지만 산화적인 속성을 지닌 IIa와 지근 섬유인 I이 증가한다는 것을 immunoblotting을 통한 정량적 방법으로 확인하였다(Fig. 1). 운동 트레이닝은 type IIb 섬유 유형을 IIx로 또는 IIx 섬유 유형을 IIa로 전환시키는 것으로 알려져 있는데[5-7], 본 연구의 immunofluorescence 결과(Fig. 2)는 type IIb와 IIx가 감소하고 그곳에 산화적 섬유인 IIa와 I이 혼합된 형태로 증가될 가능성을 보여주므로 이를 명확하게 증명하기 위한 추가 연구가 요구된다.
생쥐의 TA 근육은 99% 이상이 Type II 섬유로 구성되어 있으며[22], plantaris 근육과 함께 속근에서 지근으로 섬유유형의 전환 연구에 많이 사용되고 있다. 8주간 지구성 운동으로 완전히 전환된 type I 근섬유는 확인할 수 없었으나 모든 type II 근섬유에서 type I MHC가 발현됨으로써 운동 기간이 더 길어진다면 type II가 I 섬유로 전환될 가능성이 있으므로 이를 확인하기 위한 추가 연구가 요구된다.
골격근 MHC의 유형의 변화뿐만 아니라 8주간 지구성 운동으로 ATP synth, CYTO C 및 NADH가 대조군보다 증가하여 근 섬유의 대사적 속성이 트레이닝 전보다 산화적으로 전화되었다(Figs. 1B, 3). 근섬유의 수축 속성은 sarcoplasmic reticulum calcium-ATPase (SERCA)에 의하여 조절될 수 있는데[34], 이는 SERCA의 아형에 따라 수축에 필요한 칼슘 펌프 속도 차이가 나타나기 때문이다. 지근섬유에서는 주로 SERCA2a 아형이 발현되며, 속근섬유에는 주로 SERCA1a 아형이 발현된다[7,35]. 본 연구의 8주간 지구성 운동 트레이닝은 골격근 SERCA2a의 발현을 증가시키는 것으로 나타났으며, 이는 근섬유 수축 속도 감소의 간접적인 근거가 될 수 있다. 그러나 SERCA2a의 발현이 근수축 속도 감소의 직접적인 증거가 될 수 없으므로 근 유형의 변화를 직접 확인할 수 있도록 운동 강도, 시간 및 기간을 조절하여 근 수축 속도와 러닝 시간 등을 비교하는 후속 연구가 요구된다.
Fig. 1.Fig. 1.Myosin heavy chain subtype, mitochondria and SERCA2a protein expression after long-term endurance exercise for 8 week. IIb, type IIb; IIx, type IIx; IIa, type IIa; I, type I muscle fiber; Sed, sedentary; Ex, exercise; ATP syn, ATP synthase; CYTO C, cytochrome C; NADH, NADH ubiquinone oxidoreductase; SERCA2a, sarco/endoplasmic reticulum Ca2+-ATPase 2a. *p<.01 significantly different from Sed. 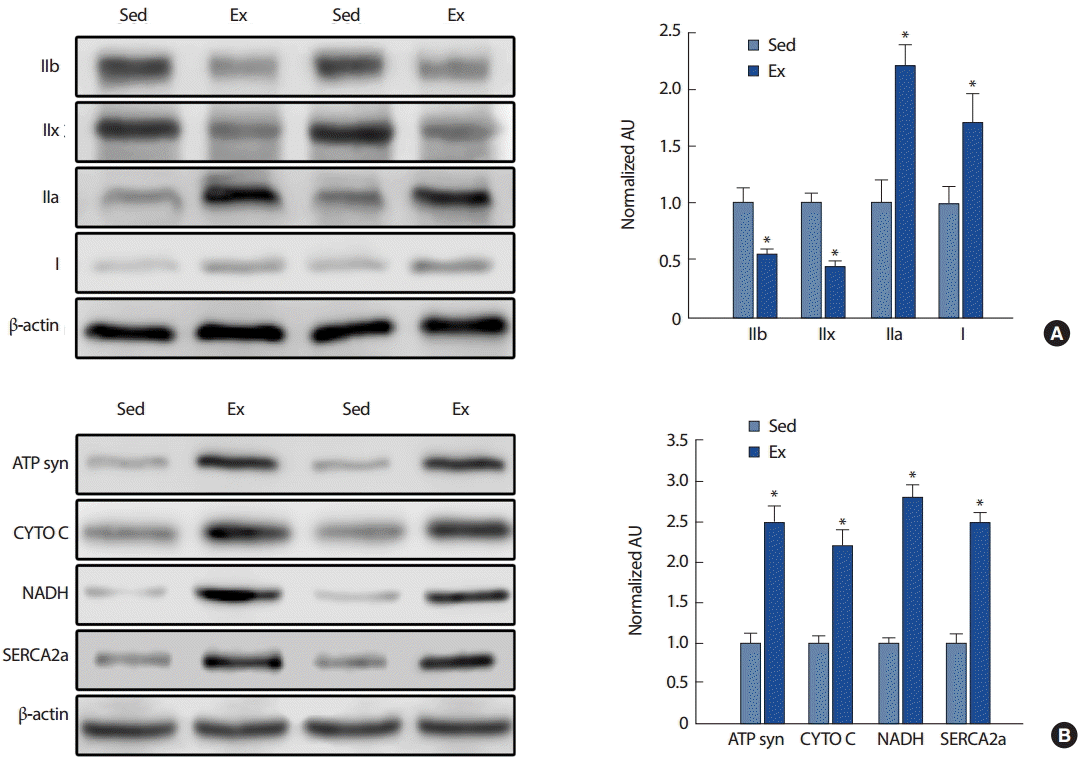
Fig. 2.Fig. 2.Representative images of mice tibialis anterior (TA) muscle MHC expression after endurance running exercise for 8 weeks. (A) Type I (blue), type IIa (green), type IIb (red), type IIx (unstained), (B) Merged image. Sed, sedentary; Ex, low intensity endurance running exercise for 8 weeks. 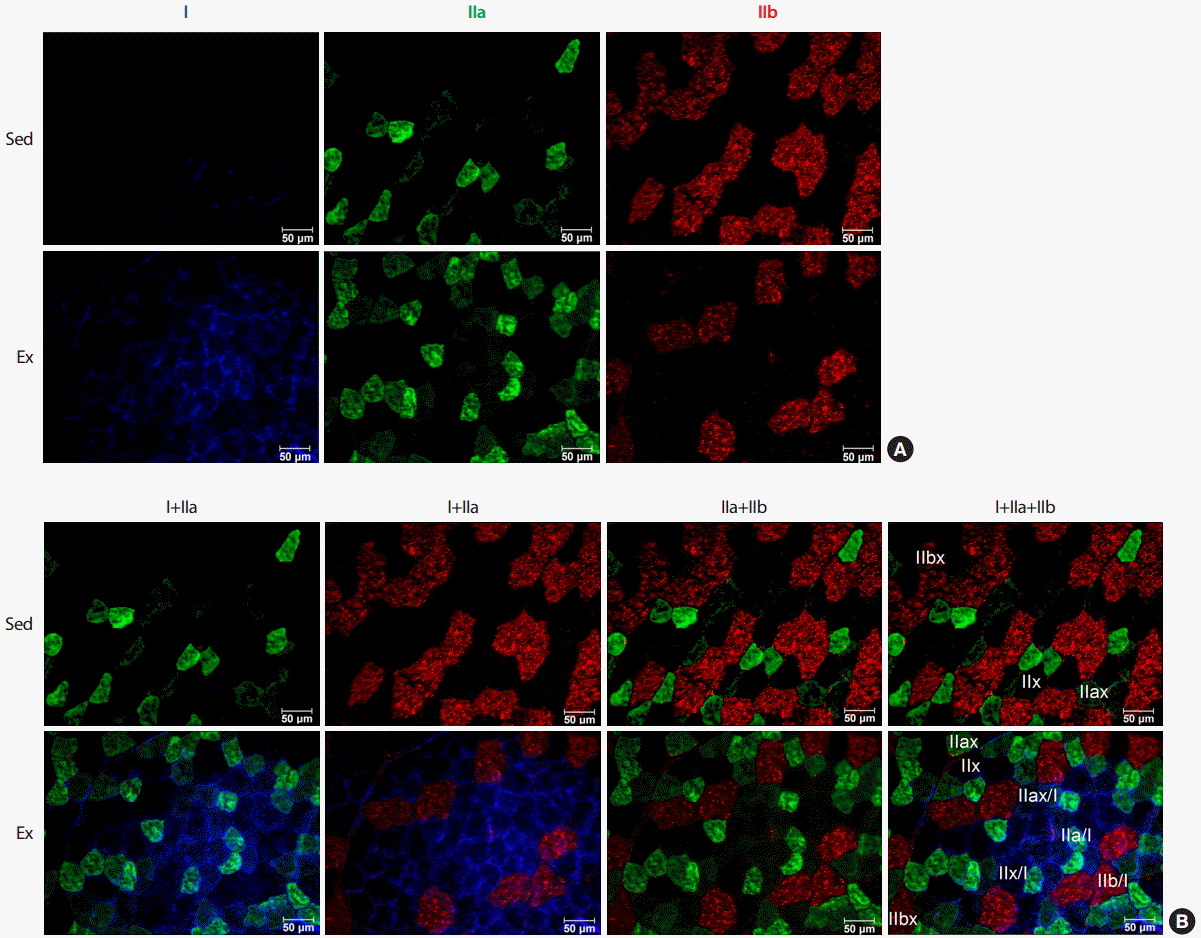
REFERENCES1. Buller AJ, Eccles JC, Eccles RM. Interactions between motoneurones and muscles in respect of the characteristic speeds of their responses. The Journal of Physiology. 1960;150(2):417-439.
2. Holloszy JO. Biochemical adaptations to exercise: aerobic metabolism. Exercise and sport sciences reviews. 1973;1(1):45-71.
3. Oscai LB, Holloszy JO. Biochemical adaptations in muscle. II. Response of mitochondrial adenosine triphosphatase, creatine phosphokinase, and adenylate kinase activities in skeletal muscle to exercise. Journal of biological chemistry. 1971;246(22):6968-6972.
4. Lin J, Wu H, Tarr PT, Zhang CY, Wu Z, et al. Transcriptional co-activator PGC-1|alpha.| drives the formation of slow-twitch muscle fibres. Nature. 2002;418(6899):797-801.
5. Fitts RH, Widrick JJ. Muscle mechanics: adaptations with exercise-training. Exercise and Sport Sciences Reviews. 1996;24:427-473.
6. Gollnick PD, Armastrong RB, Stltin B, Saubert CWIV, Sembrowich WL, et al. Effect of training on enzyme activity and fiber. Journal of Applied Physiology. 1973;34(1):107-111.
7. Tupling AR. The Sarcoplasmic Reticulum in Muscle Fatigue and Disease: Role of the Sarco(endo)plasmic Reticulum Ca2+-ATPase. Canadian Journal of Applied Physiology. 2004;29(3):308-329.
8. Adams GR, Hather BM, Baldwin KM, Dudley GA. Skeletal muscle myosin heavy chain composition and resistance training. Journal of Applied Physiology. 1993;74(2):911-915.
9. Andersen JL, Klitgaard H, Saltin B. Myosin heavy chain isoforms in single fibres from m. vastus lateralis of sprinters: influence of training. Acta Physiologica Scandinavica. 1994;151(2):135-142.
10. Bergh U, Thorstensson A, Sjödin B, Hulten B, Piehl K. Maximal oxygen uptake and muscle fiber types in trained and untrained humans. Medicine and Science in Sports. 1978;10(3):151-154.
11. Carroll TJ, Abernethy PJ, Logan PA, Barber M, McEniery MT. Resistance training frequency: strength and myosin heavy chain responses to two and three bouts per week. European Journal of Applied Physiology. 1998;78(3):270-275.
12. Esbjörnsson M, Hellsten-Westing Y, Balsom PD, Sjödin B, Jansson E. Muscle fibre type changes with sprint training: effect of training pattern. Acta Physiologica Scandinavica. 1993;149(2):245-246.
13. Harridge SD, Bottinelli R, Canepari M, Pellegrino MA, Reggiani C, et al. Whole-muscle and single-fibre contractile properties and myosin heavy chain isoforms in humans. Pflügers Archiv - European Journal of Physiology. 1996;432(5):913-920.
14. Howald H, Hoppeler H, Claassen H, Mathieu O, Straub R. Influences of endurance training on the ultrastructural composition of the different muscle fiber types in humans. Pflügers Archiv - European Journal of Physiology. 1985;403(4):369-376.
15. Jansson E, Sjödin B, Tesch P. Changes in muscle fibre type distribution in man after physical training. A sign of fibre type transformation? Acta Physiologica Scandinavica. 1978;104(2):235-237.
16. Liu Y, Schlumberger A, Wirth K, Schmidtbleicher D, Steinacker JM. Different effects on human skeletal myosin heavy chain isoform expression: strength vs. combination training. Journal of Applied Physiology. 2003;94(6):2282-2288.
17. Mcguigan MRM, Kraemer WJ, Deschenes MR, Gordon SE, Kitaura T, et al. Statistical analysis of fiber area in human skeletal muscle. Canadian Journal of Applied Physiology. 2002;27(4):415-422.
18. Paddon-Jones D, Leveritt M, Lonergan A, Abernethy P. Adaptation to chronic eccentric exercise in humans: the influence of contraction velocity. European Journal of Applied Physiology. 2001;85(5):466-471.
19. Staron RS, Pette D. The continuum of pure and hybrid myosin heavy chain-based fibre types in rat skeletal muscle. Histochemistry. 1993;100(2):149-153.
20. Schiaffino S, Reggiani C. Myosin isoforms in mammalian skeletal muscle. Journal of Applied Physiology. 1994;77(2):493-501.
21. ACSM. ACSMs advanced exercise physiology. Philadelphia: Lippincott Williams & Wilkins 2006;(pp. 164.
22. Bloemberg D, Quadrilatero J. Rapid Determination of Myosin Heavy Chain Expression in Rat, Mouse, and Human Skeletal Muscle Using Multicolor Immunofluorescence Analysis. PloS One. 2012;7(4):e35273.
23. Booth FW, Laye MJ, Spangenburg EE. Gold standards for scientists who are conducting animal-based exercise studies. Journal of Applied Physiology. 2010;108(1):219-221.
24. Gorza L. Identification of a novel type 2 fiber population in mammalian skeletal muscle by combined use of histochemical myosin ATPase and anti-myosin monoclonal antibodies. The Journal of Histochemistry and Cytochemistry : Official Journal of the Histochemistry Society. 1990;38(2):257-265.
25. Rivero JLL, Talmadge RJ, Edgerton VR. Fibre size and metabolic properties of myosin heavy chain-based fibre types in rat skeletal muscle. Journal of Muscle Research & Cell Motility. 1998;19(7):733-742.
26. Rockl KSC, Witczak CA, Goodyear LJ. Signaling mechanisms in skeletal muscle: acute responses and chronic adaptations to exercise. IUBMB Life. 2008;60(3):145-153.
27. Gan Z, Burkart-Hartman EM, Han D-H, Finck B, Leone TC, et al. The nuclear receptor PPARβ/δprograms muscle glucose metabolism in cooperation with AMPK and MEF2. Genes & Development. 2011;25(24):2619-2630.
28. Kim SH, Kim KJ, Jung SR, Koh JH. How Long Days it have to Mature Mitochondrial Function after Repetitive Bouts of Prolonged Endurance Exercise Training. The Korean Journal of Physical Education. 2015;54(2):377-383.
29. Lowry OH, Rosebrough NJ, Farr AL, Randall RJ. Protein measurement with the Folin phenol reagent. The Journal of Biological Chemistry. 1951;193(1):265-275.
30. Pette D, Staron RS. Myosin isoforms, muscle fiber types, and transitions. Microscopy Research and Technique. 2000;50(6):500-509.
31. Pette D, Staron RS. Transitions of muscle fiber phenotypic profiles. Histochemistry and Cell Biology. 2001;115(5):359-372.
32. Aagaard P, Andersen JL. Correlation between contractile strength and myosin heavy chain isoform composition in human skeletal muscle. Medicine and Science in Sports and Exercise. 1998;30(8):1217-1222.
33. FRY AC, Schilling BK, Staron RS, Hagerman FC, Hikida RS. Muscle fiber characteristics and performance correlates of male Olympic-style weightlifters. The Journal of Strength, Conditioning Research. 2003;17(4):746-754.
|
|
||||||||||||||||||||||||||||||||||||||||