젖산이 골격근세포 내 마이오카인 발현에 미치는 영향
Effects of Lactic Acid on the Expression of Myokines in C2C12 Myotubes
Article information
Trans Abstract
PURPOSE
During high intense exercise, the level of lactic acid (LA) increases over 10 mM, and LA has functions as an intermediate for muscular energy metabolism. However, the effects of LA on the level of myokines remain largely unknown. Aims of this study were to evaluate whether LA regulates the expression of myokines in C2C12 myotubes and to explore the regulatory mechanisms.
METHODS
As a number of studies reported that intense exercise induced accumulation of 4-20 mM LA in blood, C2C12 myotubes were treated with LA of 0, 4 or 16 mM for 0.5, 1 or 4 hr. We measured mRNA and protein levels of myostatin (Mstn), and fibronectin type III domain-containing protein 5 (FNDC5) using real-time PCR or western blot, respectively.
RESULTS
LA reduced the levels of both mRNA and protein of Mstn from 4 hr after treatment. The level of FNDC5 mRNA was increased by LA within 1 hr, which returned to the basal level at 4 hr. but not increased the expression of FNDC5 protein levels. The levels of phosphorylated 5-AMP activated protein kinase (p-AMPKThr172) show an increasing trend but its target phosphorylated acetyl-CoA carboxylase at Ser79 (p-ACCser79) was increased by LA within 30 min.
CONCLUSIONS
Our results demonstrated the regulatory effect of LA on myokine expression, indicating that LA may be a metabolic factor contributing to secretory functions of skeletal muscle during high intensity physical exercise. In addition, LA accumulation at early time of physical exercise may influence on the signaling of intracellular energy metabolism, although further studies are needed to confirm our hypotheses.
서 론
젖산(lactic acid)은 운동에 의한 신체변화의 주요 대사적 변수 중 하나로 운동강도와 운동유형, 운동지속시간과 높은 연관성을 보이며, 젖산 축적이 근피로(fatigue)에 관여한다는 기존 연구들[1,2]에 의해 각종 스포츠 현장에서 혈중 젖산 농도의 축적을 운동부하 강도의 지표로써 사용하고 있다[1].
젖산이 근육 내에서 어떠한 기능을 하는지에 대한 논란은 계속되고 있으나, 운동 후 근 통증 및 피로를 유발하는 강산성의 물질로 인식하던 과거 연구[3]와 달리, 최근 젖산은 젖산탈수소효소(lactate dehydrogenase; LDH)를 통해 초성포도산(pyruvic acid)으로 전환되어 에너지원으로 재사용할 수 있도록 할 뿐만 아니라 운동 시 세포 내 형성된 수소이온을 완충(buffering)하고, 간에서의 포도당신생(gluconeogenesis) 물질을 제공하는 에너지대사의 중간 매개체로 보는 경향이 증가하는 추세다[4-6]. 따라서 젖산은 기존의 선행연구에서 제시한 유·무산소 운동의 역치(threshold) 기준에 관한 연구뿐만 아니라, 젖산 시스템에서의 무산소 대사와 관련된 고강도 유산소 운동 및 저항성 운동의 생리적 반응과 적응, 그리고 골격근의 수축 기전과 관련된 연구가 주요 관심사로 대두되고 있다[7].
Pedersen et al. [8]은 근 수축 시 골격근에서 발현되는 활성 인자들을 마이오카인(myokine)이라 명명하였으며, 이는 근육 섬유에서 분비되는 단백질 및 호르몬이 근육세포에 직접적으로 영향을 미치거나(autocrine effect), 근육세포의 주변조직(paracrine effect), 또는 혈류를 통해 다른 조직에 영향을 미치는(endocrine effect) 것이라고 정의하였다[9]. 대표적인 마이오카인으로는 마이오스타틴(myostatin; Mstn), 인터류킨-6 (interleukin-6, IL-6), 아이리신(Irisin) 등이 있다.
Mstn은 transforming growth factor beta (TGF-β)군에 속하는 유전자로[10], 근육 세포에 직접적으로 작용하여 근육의 생성(myogenesis) 및 근육세포 분화(differentiation)를 억제하는 단백질이다[11]. 여러 선행연구에서 Mstn 유전자를 넉다운(knock-down)하거나 넉아웃(knock-out)하여 근육의 비대(hypertrophy) 및 인슐린 저항성을 감소시킨다고 보고하고 있으며[10,11], 운동 시 Mstn의 발현량이 감소함에 따라 근육의 크기가 증가한다고 알려져 있다[12]. Irisin은 미토콘드리아 생합성(mitochondrial biogenesis)에 관여하는 peroxisome proliferator-activated receptor γ coactivator-1α (PGC-1α) 및 fibronectin type III domain containing 5 protein (FNDC5; a precursor of Irisin)에 의해 분비되며, 근육에서 분비되어 백색지방을 갈색지방화(fat browning)하고, 미토콘드리아 내막에 있는 uncoupling protein 1 (UCP1)의 발현을 유도하여 열 에너지를 발생시키고, 이에 따라 지방 감소 및 에너지 소비를 증가시키는 역할을 한다고 보고되어 있다[13].
여러 선행연구[9,14]에서 IL-6 및 Irisin 등의 마이오카인은 운동 시 혈장에서 급격히 증가하는 형태를 보이며, 운동 강도와 양의 상관관계를 보인다. 이는 고강도 운동이 여러 기전을 통해 마이오카인의 발현을 증가시킨다는 것을 의미하며, 젖산 시스템에서의 무산소 대사와 관련된 고강도 유산소 운동 및 저항성 운동 시 급격히 증가하는 젖산 역시 마이오카인의 발현에 영향을 미치거나 관련성이 있을 수 있다. 특히, 젖산이 에너지대사에 관여하는 대사 물질로[4,5] 인지됨에 따라 에너지대사에 관여하는 AMPK와 PGC-1α의 하위인자(downstream)인 Irisin이 젖산과 밀접한 관련이 있을 수 있다. 그럼에도 불구하고, 현재까지 고강도 유·무산소 운동 시 생성되는 젖산이 마이오카인의 발현과 기능에 미치는 영향에 대한 검토가 이루어지지 않고 있다.
따라서 본 연구는 고강도 유·무산소 운동과 저항성 운동 시 생성되는 젖산에 따른 마이오카인의 변화 관찰을 목적으로 하며, 골격근세포에 농도 및 시간 별로 젖산을 처리한 후 Mstn 및 Irisin의 발현량을 각각 확인하고, 에너지대사 단백질(protein)의 발현 정도를 비교, 분석하여 젖산시스템과 관련된 골격근 내의 생리활성인자의 기전을 연구하는 데 활용될 수 있는 기초자료를 제공하고자 한다.
연구 방법
1. 연구 방법
1) 세포배양 및 분화
American Type Culture Collection (ATCC; CRL-1772, Manassas, VA, USA)에서 구입한 골격근세포주인 C2C12는 100 mm 배양접시에 2.2×106으로 분주(seeding)한 후, Fetal bovine serum (FBS; Gibco-Brl, Grand Island, NY, USA) 10% 및 Pecicillin-Streptomycin (PS; Gibco-Brl, Grand Island, NY, USA) 1%를 첨가한 Dulbecco’s Modified Eagle’s Medium (DMEM; Gibco-Brl, Grand Island, NY, USA) high glucose배양액(growth media)을 10 mL씩 교체(renewal)하였다.
C2C12 근육세포가 배양접시에 70% 정도 차면, 6 well plates에 3 mL 당 0.3×106/mL으로 계대배양(Subculture)하였다. 근아세포(myoblast)가 90% 차는 것을 확인한 후, Horse Serum (HS; Gibco-Brl, Grand Island, NY, USA) 2% 및 PS 1%를 함유한 DMEM high glucose 분화용 배양액을 사용하여 37℃, 5% CO₂환경에서 6일간 분화를 유도하였다. 분화용 배양액은 매일 교체하였으며, 6일간의 배양 후 근아세포 상태의 C2C12 세포들이 다핵성 근관세포로 분화되는지 확인하였다(Fig. 1).
2) 젖산처리
6일간 분화시킨 근관세포는 1% PS를 함유한 무혈청배지로 16시간 동안 starvation 시킨 후, L-lactic acid (Sigma-Aldrich, St. Louis, MO, USA)을 처리하였다. 젖산은 비 운동 시 혈액 내에서 1 mM [31] 정도로 존재하다가, 고강도 운동 시 근육 및 혈액 내에서 4-20 mM의 젖산이 생성된다는 여러 선행연구[16,17,18]에 따라 젖산을 0 mM, 4 mM, 16 mM로 각각 처리(treat) 하였으며, 운동 후 30-60분 정도 소요되면 대부분의 젖산이 안정 시 상태로 산화된다[7]는 선행 연구에 따라 0.5시간, 1시간, 4시간으로 젖산 발현 정도를 설정하였다.
3) 실시간 중합효소연쇄반응(RT-PCR)
각 농도 별로 젖산을 처리한 근관세포로부터 RNA (ribonucleic acid)를 분리하기 위해 Trizol reagent (Invitrogen, Carlsbad, CA) 0.5 mL을 넣고 세포를 수거한 후, Chloroform (Sigma-Aldrich, St. Louis, MO, USA) 100 μL를 넣고 2분간 실온에서 배양하였다. Centrifuge (12,000×G, 4℃, 15분) 후, 투명한 상층액 200 μL를 따로 분리하여 2-Propanol (Sigma-Aldrich, St. Louis, USA) 250 μL를 넣고 실온에서 10분간 배양 후, Centrifuge (12,000×G, 4℃, 10분)하였다. 고체의 알갱이(Pellet)만 남기고, 용액을 완전히 제거한 후, 75% Ethanol 1 mL을 넣고 Centrifuge (7,500×G, 4℃, 5분)하였다. 알갱이만 남기고 용액을 완전히 제거한 후, 알갱이가 투명해질 때까지 실온에서 방치하였다(airdry). 이 후, DEPC (Diethylpyrocarbonate) H2O 100 μL를 넣은 후, ND-1,000 spectro-photometer (NanoDrop technologies, Wilmington, DE, USA)으로 정량하였다.
분리된 RNA는 유전자 발현 분석을 위해 Takara Bio Inc. (Shiga, Japan) 의 cDNA synthesis kit를 사용하여 cDNA로 합성(synthesis)하였다. 합성된 cDNA의 유전자 발현 분석을 위해 RT-PCR 기법을 사용하였으며, 합성된 cDNA 2 μL에 Power SYBR Green PCR Master Mix (Applied Biosystems, Foster City, CA, USA) 10 μL와 10 pM의 primer 2 μL를 넣고 3차 증류수를 넣어 20 μL를 만들었다. 이때, 사용된 Primer의 sequence는 Table 1과 같다. 이 후, 7500 Real-Time PCR system (Applied Biosystems, Foster City, CA, USA)을 사용하여 RNA의 발현량을 확인하였다.
PCR은 50℃에서 20초 동안 변성 후, 95℃로 10분동안 예비 변성하였다. 이 후, 95℃에서 15초, 60℃에서 1분으로 40 cycles 반복 수행하였으며, 발현량을 보정하기 위해 항존 유전자인 GAPDH (glyceraldehyde-3-phosphate dehydrogenase)를 이용하여 발현 값을 산출하였다.
4) 웨스턴블롯(Western blot)
단백질의 양을 측정하기 위해 6일간 분화시킨 근관세포를 Tris-HCl, NaCl이 포함된 Radio-Immunoprecipitation Assay (RIPA) buffer에 10% SDS 1%, Protease Inhibitor cocktail 1%, Phos Stop 10%를 실험 직전 첨가하여 100 μL씩 넣고 세포를 수거하였다. Sonication (4watt, 5초, 3회)하여 세포를 파쇄한 후, Centrifuge (14,000×rpm, 4℃, 10분)하여 단백질이 포함된 상층액을 획득하고, BCA Assay 방법으로 정량 분석하였다.
정량한 단백질에 1M DTT (dithiothreitol)와 250 mM Tris-HCl, 40% glycerol, 8% SDS, 0.01% bromophenol blue가 섞인 4X sample buffer와 RIPA buffer를 단백질 양에 맞게 섞어준 후 100℃에서 10분간 용해하였다. 4-20% SDS-polyacrylamide gel (SDS-PAGE; Bio-Rad, Hercules, California, USA)을 이용하여 전기영동(200V, 4℃, 40분) 한 후, Poly Vinylidene Difluoride (PVDF; Milipore, USA) membrane과 Pure Nitrocellulose Blotting (NC; Pall corporation, Mexico) membrane에 각각 Transfer (200 mA, 4℃, 1시간)하였다.
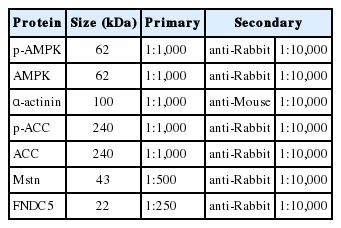
전이가 완료된 membrane은 ponceaus staining으로 염색하여 밴드 내 거품이 삽입되었는지 확인하고, 0.4% PFA로 30분간 fixation 시킨 후, 5% Bovine Serum Albumin (BSA; Sigma-Aldrich, St. Louis, USA) 30 mL에 담가 상온에서 1시간 동안 blocking 하였다. 이 후, 1차 항체(Primary Antibody)를 사용하여 4℃에서 overnight (16시간) 하였다(Table 2).
0.2 M Tris-HCl, 1.37 M NaCl, 1% Tween 20을 조합해 만든 Tris Buffered- Saline (TBS-T;) 용액으로 5분씩 6번 세척하고, 1차 항체에 반응시킨 PVDF membrane과 NC membrane은 5% skim milk에 일정 비율로 희석한 2차 항체(secondary antibody) 를 붙여 실온에서 1시간동안 결합하였다(Table 2). 다시 TBS-T 용액으로 5분씩 6번 세척한 후, Enhanced Chemiluminescence Detection reagent (ECL; Thermo-scientific, Massachusetts, USA) A와 B를 1:1 비율로 희석하여 membrane 위에 뿌리고, 암실에서 필름에 노출시켜 protein band를 현상하였다.
3. 자료 처리 방법
mRNA의 발현은 수치화된 CT값으로 비교 분석하고, 단백질 발현 양상은 Quantity one으로 band의 농도를 정량하여 수치화하였다. 두 데이터는 모두 SPSS 18.0 통계 프로그램을 이용하여 평균과 표준편차를 산출하고, 측정변인들에 대한 농도 별 평균의 차이 검증은 비모수적 검정으로서 Mann-Whitney U-test를 이용하였다. 이때 통계적 유의수준(α)은 5%일 때 유의성이 있다고 판단하였다.
연구결과
본 연구에서는 운동 시 축적되는 젖산이 근육세포에서 분비되는 Mstn과 Irisin의 발현 수준에 어떠한 영향을 미치는지 알아보고자 하였다. 젖산 농도와 시간에 따른 Mstn과 Irisin의 발현 수준을 확인한 후 에너지대사 지표의 발현 정도를 추가적으로 확인하여 젖산이 근육 내에서 어떠한 작용을 하는지 알아보고자 C2C12 세포배양을 통해 in vitro 수준에서 관찰하였다.
1. 젖산 농도와 시간에 따른 Mstn 발현 양상
Mstn과 젖산의 연관성을 알아보기 위해 Mstn mRNA와 단백질을 각각 수거하여 비교 관찰하였다. 젖산의 농도 특이성을 고려하여 0 mM, 4 mM, 16 mM을 처리한 후 mRNA 수준에서 관찰한 결과, 짧은 시간 동안의 젖산 처리(30분, 1시간)에서는 Mstn의 mRNA 발현 수준에서 유의한 차이를 보이지 않았으나, 장시간(4시간)의 젖산 처리는 Mstn mRNA를 유의하게 감소하는 것을 확인하였다(p<.01) (Fig. 2).

Effect of LA on the Mstn mRNA expression.
*p<.05 and **p<.01 compared with control using the Mann-Whitney U test.
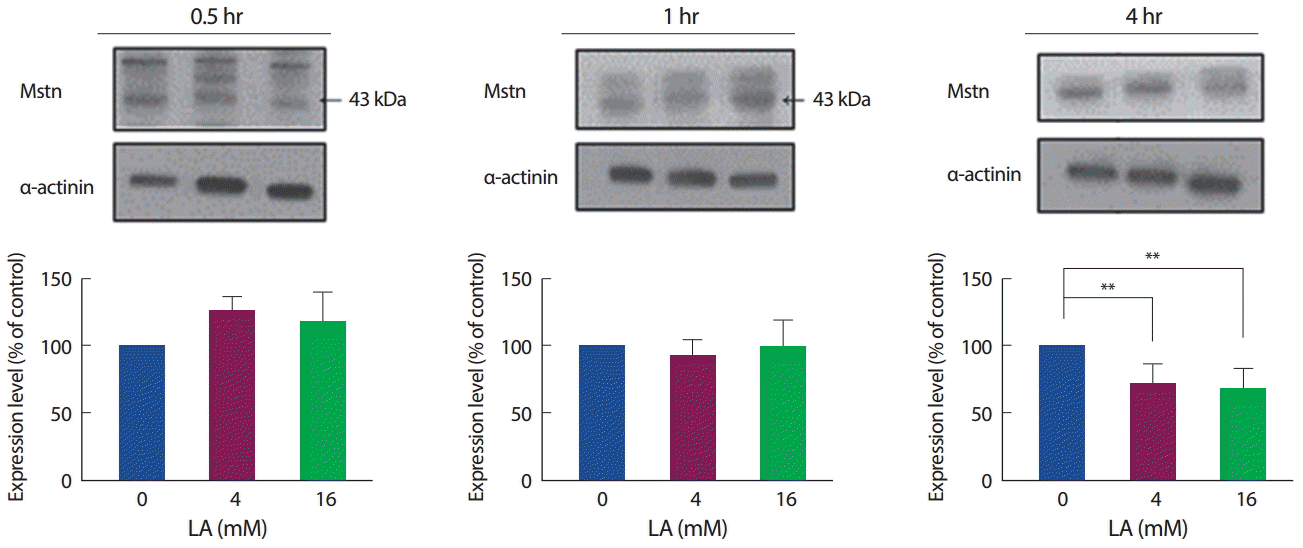
젖산 처리에 따른 Mstn의 단백질 발현수준 역시 mRNA와 마찬가지로, 30분과 1시간에서는 유의한 차이를 보이지 않았으나, 4시간 수준에서 4 mM과 16 mM 모두 유의하게 감소하였다(p<.01). 즉, 젖산은 처리 시간에 따라 Mstn의 mRNA와 단백질 발현량을 감소시킨다(Fig. 3).
2. 젖산 농도와 시간에 따른 FNDC5 발현 양상
젖산 처리에 따른 FNDC5 mRNA 발현과 관련하여, 30분간 4 mM의 젖산 처치에서는 증가하는 경향을 보였으나 16 mM의 젖산 처리에서는 유의하게 감소하였다(p<.05). 반면에 1시간 처리에서는 4 mM에서 유의하게 증가하였고(각각 p <.01) 16 mM에서는 유의하진 않았으나 증가하는 경향을 보였으며, 4시간 동안의 처치에서는 모두 유의한 차이를 보이지 않았다(Fig. 4).
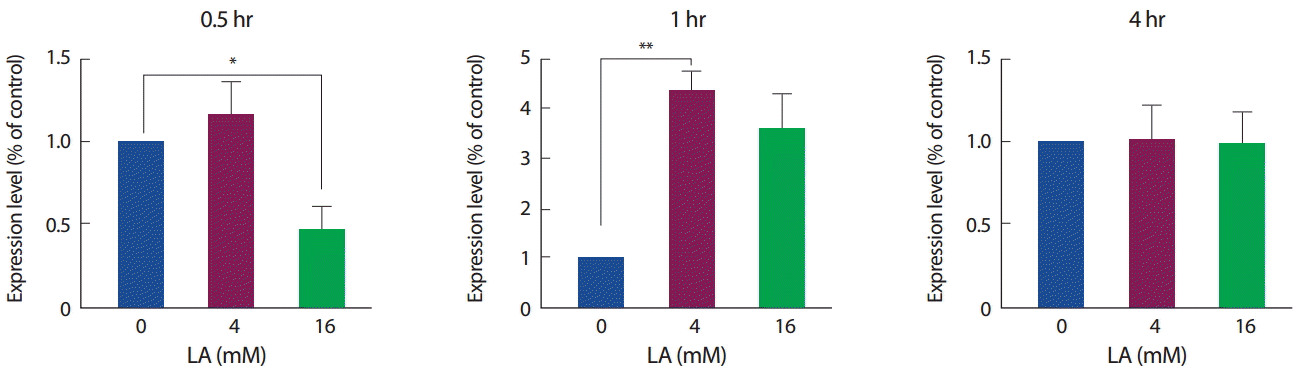
Effect of LA on the FNDC5 mRNA expression.
*p<.05 and **p<.01 compared with control using the Mann-Whitney U test.
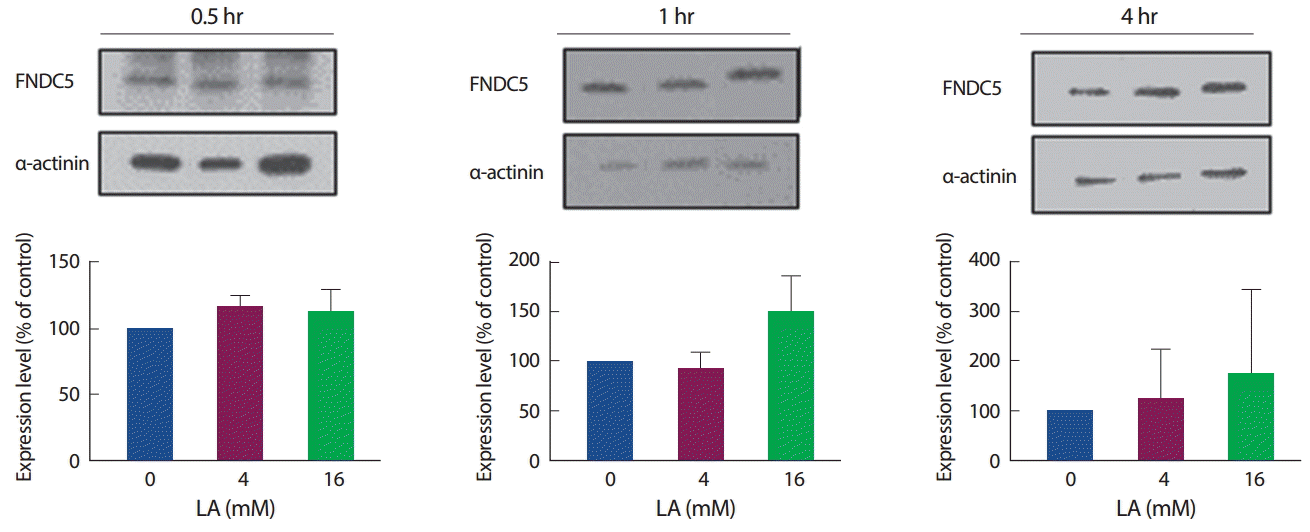
FNDC5의 단백질 발현 양상의 경우, 30분, 1시간, 4시간에서 모두 유의한 차이를 나타내지 않았으며, 1시간, 4시간 수준에서는 16 mM에서만 증가하는 경향을 보였다(Fig. 5). 이는 mRNA 발현 양상과는 조금 다른 경향을 보였으며, 단백질 수준에서는 변화를 보이지 않았으나 mRNA 발현수준을 변화시키는 것으로 보아 젖산이 FNDC5의 발현에 어느 정도 영향을 미칠 수 있을 것으로 보인다.
3. 젖산처리 후 골격근세포 내 에너지대사지표 발현 비교
세포 내에서 에너지 대사 조절에 중요한 기전으로 작용하는 AMPK와 ACC가 젖산 농도와 시간에 따라 어떠한 차이가 있는지 확인하였다. 먼저, P-AMPK를 AMPK 수준으로 비교하여 AMPK의 활성(인산화)을 확인한 결과, 젖산 처리 30분에는 4 mM, 16 mM에서 증가하는 경향을 보였으나 유의하진 않았으며, 마찬가지로 젖산 처리 1시간과 4시간에서도 유의한 차이는 나타나지 않았다(Fig. 6).
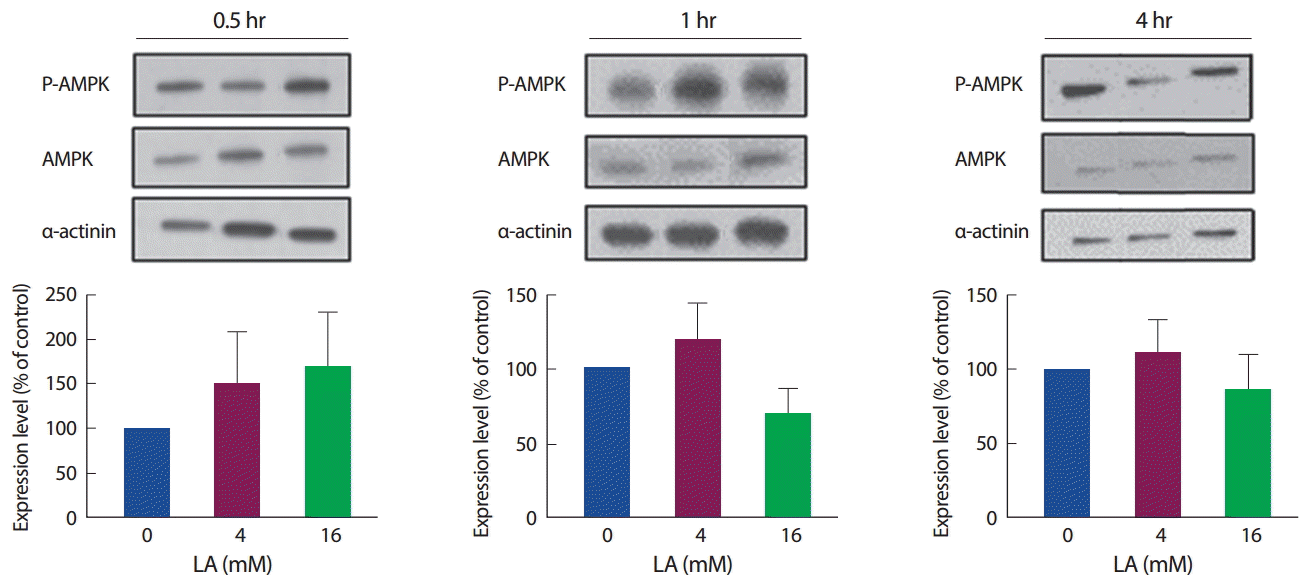
Effect of LA on the AMPK protein expression.
*p<.05 and **p<.01 compared with control using the Mann-Whitney U test.
이후, AMPK의 하위인자인 ACC의 활성을 보기 위해 P-ACC를 ACC 수준으로 비교하여 분석하였다. 젖산을 30분간 처리하였을 때 4 mM에서만 유의하게 증가하였다(p <.05). 이후 1시간부터 다시 원래 수준으로 되돌아오는 것으로 관찰되었으며, 4시간 수준에서는 고농도인 16 mM에서 뚜렷하게 감소하는 것을 확인하였다(p<.01). 결과적으로 ACC의 활성은 AMPK의 인산화 수준과 비슷한 양상으로 발현됨을 확인하였으며(Fig. 7), 에너지대사에 관여하는 AMPK와 ACC의 발현 수준은 젖산 처리 초기에 증가하는 형태를 보였다가 시간 경과에 따라 원래 상태로 되돌아가는 경향을 보였다.
논 의
본 연구는 골격근세포 내에서 농도 별, 시간 별로 처리된 젖산과 마이오카인의 관련성을 관찰하여 젖산의 역할을 규명하는데 목적이 있었다.
일반적으로 젖산은 신체활동에 의한 대사적 부산물로써, 근육과 혈액의 pH를 감소시켜 피로감을 유발하고, 에너지 대사과정을 둔화시키는 운동수행능력 저하의 주요 원인으로 간주되어 왔다[1,2]. 그러나 최근 여러 선행연구에서는 운동 시 세포 내 형성된 수소이온을 젖산이 완충할 뿐만 아니라, 간에서의 포도당신생물질을 제공하는 에너지 기질로 보는 추세다[4,5]. 이와 같이 젖산 기능에 관한 연구는 ‘젖산 혁명’을 전, 후로 새롭게 재조명 받고 있으며, 특히 Brooks [19]의 연구에서 제시된 바와 같이 젖산 수송 및 산화에 의한 에너지대사 중간 산물로의 가능성은 근육 내 기전 연구에 대한 새로운 이론을 제시할 수 있을 것으로 판단된다.
본 연구 또한 젖산이 에너지대사에 관여하는 중간 매개물질로의 기능에 중점을 두고, 근육 내에서 에너지대사에 의해 발현 수준이 변하는 것으로 알려진 마이오카인의 발현 정도를 확인하여 젖산의 대사적 기능과 마이오카인의 상관성을 확인해보고자 하였다. 이를 위해 AMPK의 활성에 따라 발현량이 달라지는 대표적인 마이오카인인 Mstn과 FNDC5 (Irisin의 전구체)의 발현 수준을 비교 관찰하였다.
본 연구 결과에서 Mstn mRNA와 단백질 발현 수준은 젖산 처리 4시간 수준에서 유의하게 감소되는 것을 확인하였다. 이러한 결과는 젖산이 근육 내에서 4 mM 이상 그리고 4시간 이상 축적되었을 때 근비대를 유도할 수 있음을 시사하는 것이다. 즉, 근육 내 젖산의 오랜 축적을 요구하는 고강도 운동 시 수축성 단백질의 합성에 의해 근 질량이 증가하는데[20], 젖산의 증가에 따라 Mstn의 발현 수준이 감소함으로써 근 질량을 증가시킬 수 있을 것으로 사료된다. 이를 뒷받침하는 결과로, Patel et al. [21]연구에서 10일동안 매일 30분간 운동 시 근질량은 증가하고, Mstn 발현 수준은 감소하는 것을 확인하였으며, 근비대에 효과적인 고강도 저항성 운동 시 Mstn의 발현 수준이 감소한다고 보고하였다[22]. 본 연구에서는 기전적 결과를 제시하기에 한계가 있기 때문에 선행연구를 통해 가능성을 제시하면, Groussard et al. [23]의 연구 결과에서는 골격근 세포 내 젖산이 superoxide anion (O2)와 hydroxide (OH)를 제거(scavenging)함으로써 hydrogen peroxide (H2O2)가 감소할 수 있으며, 이는 골격근에서의 H2O2 증가가 Mstn의 발현을 유도한다는 Sriram et al. [24]의 연구결과와 연관 지어 보았을 때, 젖산이 H2O2를 감소시킴으로써 Mstn의 발현 수준이 감소했을 것이라 예측할 수 있다.
또한, 본 연구결과에서 AMPK의 발현이 젖산 처리 30분에서 유의한 차이는 없었으나, 증가하는 경향을 보였으며, 4시간 수준에서는 큰 변화를 보이지 않는 것으로 보아, 젖산 노출 초기에 활성화된 AMPK에 의해 Mstn의 발현이 그보다 늦은 처리 시기에 작용하는 것으로 사료된다. 이는 AMPK의 활성에 의해 Mstn의 발현 수준이 억제된다는 Miyake et al. [25] 연구결과와 유사한 형태를 보이며, 젖산이 골격근 세포 내에서 초기에 AMPK의 활성을 유도하고, 30분에서 활성화된 AMPK가 시간에 걸쳐 단백질에 영향을 미침으로써 4시간 수준에서 Mstn의 발현을 감소시킨 것으로 생각한다.
본 연구에서는 처치 시간 조건으로 0.5시간, 1시간 그리고 4시간의 처치 조건에서만의 변화를 관찰하였기에 젖산이 근육 내에서 4 mM 이상 그리고 4시간 이상 축적되었을 때 근비대를 유도할 수 있다고 제안하였으나 이것은 4 mM 이상의 젖산이 1시간 처치되고 나서 4시간 후 또는 1시간 이상 처치되고 나서 1시간 이후부터 Mstn 단백질 발현 감소가 유발되어 근비대를 유발할 수도 있음을 시사하는 것이기도 하다. 따라서 이러한 부분을 확인하기 위한 추가적인 연구가 수행되어야 할 것으로 판단된다.
한편, Irisin의 전구체인 FNDC5 mRNA는 초기 30분의 16 mM에서 유의하게 감소하였으나 1시간 처치에서는 4 mM에서만 유의하게 증가하였다. 반면 FNDC5 단백질 발현에서는 다양한 젖산농도와 처리시간에 따른 차이가 나타나지 않았다. FNDC5 mRNA가 고농도인 16 mM의 젖산을 30분간 처리하였을 때 발현 수준이 감소하는 것은 근육 내 LDH 촉매작용이 젖산을 초성포도산으로 다시 전환시킴으로 인해 NAD의 생성이 감소하고, 세포와 혈중 pH가 저하됨으로써 AMPK-PGC1a를 기전으로 하는 FNDC5의 발현 수준을 일시적으로 감소시켰을 것이라 사료된다. 이후, 젖산을 1시간 처리하였을 때 4 mM에서 FNDC5의 발현 수준이 유의하게 증가하고, 16 mM에서는 비록 유의하게 증가하지는 않았지만 증가하는 경향을 보이는 것은 30분에서 AMPK와 ACC의 산화적 인산화가 FNDC5의 발현과정에 영향을 미쳤을 것으로 추측한다. 이는 유산소성 운동이나 강도가 높은 스프린트 달리기를 했을 때 AMPK의 산화적 인산화 및 Irisin 발현 수준이 증가한다는 선행연구를 뒷받침하는 증거라고 할 수 있으며[26-28], 운동에 의해 생성되는 젖산이 Irisin의 전구체인 FNDC5의 발현수준을 증가시킬 수 있을 것으로 보여진다. 그러나, 4시간 수준에서는 젖산 농도와 상관없이 유의한 차이를 보이지 않았고, 이는 근육 내 4시간 이상의 장시간 젖산 노출은 FNDC5의 발현에 영향을 미치지 않을 것으로 판단된다.
FNDC5의 단백질 발현 수준은 젖산의 농도 및 처리시간에 관계없이 유의한 차이를 보이지 않았으며, 고농도인 16 mM에서만 1시간, 4시간 젖산 처리하였을 때 증가하는 경향만을 보였다. 이는 mRNA의 발현 수준은 변화하였으나 단백질로 합성되지는 못하였을 것으로 추측된다. 이는 젖산이 AMPK와 ACC를 활성화시킴에도 불구하고, FNDC5의 발현 수준에는 영향을 미치지 못한다는 것을 의미하며, 4시간에서 감소된 Mstn과도 연관성이 없을 수 있음을 나타낸다. 이는 Mstn 감소에 따라 FNDC5의 발현이 증가한다는 선행연구[29]와는 일치하지 않는 것으로 나타났으며, 운동 시 AMPK의 활성 증가에 의해 증가된 Irisin이 Mstn의 발현량을 감소시키고, 근 비대에 국소적으로 관여하는 IGF-1의 발현량을 증가시킨다는 선행연구[30]와도 다른 양상으로 나타냈다. 결국 젖산은 FNDC5의 mRNA 발현수준에는 영향을 미치나, 단백질 수준에서 유의한 차이를 보이지 않았기 때문에 젖산이 Irisin의 발현에 영향을 미치는지에 대한 추가 고찰을 필요로 한다.
결국, 본 연구에서 젖산은 AMPK와 ACC의 활성화로 에너지대사에 관여하여 Mstn의 mRNA와 단백질, FNDC5 mRNA 발현수준을 변화시키지만, FNDC5의 단백질 발현수준에는 영향을 미치지 않는 것으로 보여진다. 결과적으로 젖산이 골격근세포 내에서 분비되는 일부 마이오카인의 발현에 직, 간접적으로 영향을 미치고, 이는 젖산 처리에 따라 활성화 된 에너지대사인자와 밀접한 관련이 있을 것으로 사료된다. 이에 따라, 젖산과 마이오카인, 에너지대사와의 추가 기전 연구가 진행되어야 할 것이다.
결 론
운동 시 생성되는 젖산은 골격근세포 내에서 에너지대사인 ACC의 산화적 인산화를 조절함으로써 Mstn의 mRNA와 단백질, Irisin의 전구체인 irisin의 mRNA 발현에 직, 간접적으로 영향을 미칠 수 있을 것으로 판단된다. 그러나, 본 연구는 세포실험(In vitro)에 국한되어 있어 동물이나 인체 내에서 나타나는 반응과는 다를 수 있으며, 젖산은 운동 종료 후 1시간 내에 대부분의 축적량이 감소하기 때문에 in vivo를 이용하여 다양한 운동강도로 유발되는 젖산농도의 차이에 따른 세분화된 시간범위(1분-24시간)에서의 마이오카인 발현 양상에 대한 추가 연구가 진행되어야 할 것이다.