골격근의 혈류차단 후 재 관류 시 운동훈련의 형태가 골격근 재생 및 회복에 미치는 영향
The Effect of Two-Week Resistance and Endurance Training on Skeletal Muscle Repair and Regeneration after Ischemia-Reperfusion in Rat
Article information
Trans Abstract
PURPOSE
The present study examined the effect of two-week resistance and endurance training on skeletal muscle repair and regeneration after ischemia-reperfusion (IR) injury in rat.
METHODS
Ten week-old male Sprague-Dawley (SD) rats were divided into three groups (IR-CON, IR-RE, IR-EN). To evaluate different property of muscle types, soleus (SOL) and extensor digitorum longus (EDL) muscle were dissected. We conducted confocal microscope experiment and western blot for evaluating cell cycle of skeletal muscle repair and regeneration.
RESULTS
Satellite cells (SC) of SOL and EDL muscle were markedly increased after both exercise training. However myonuclear was only increased on SOL muscle. MyoD protein expression in SOL and EDL was increased after endurance exercise training.
CONCLUSIONS
It is consider that exercise training after IR injury may affect to repair and regeneration of damaged skeletal muscle positively by increasing SC and myonuclear in all exercise training, despite a little different response follow muscle types.
서 론
관절 성형과 같은 사지의 정형외과 수술(Orthopedic surgery)은 수술부위의 명확한 확보를 위하여 주변 혈류를 제한 할 목적으로 tourniquet을 이용한 완전한 혈류차단(ischemia)을 실시한다[1]. 장시간 혈류의 차단은 생리학적, 생화학적, 면역학적 변화를 일으킴으로써 혈관의 손상뿐만 아니라 골격근 및 혈관주위의 연부조직에 심각한 손상을 입히게 된다[2]. 혈류의 차단은 지속시간과는 상관없이 일회적으로 짧은 시간만으로도 염증 및 횡문근융해증(rhabdomyolysis)관련 지표를 증가시킨다[3]. Appell et al. [4]의 연구에 의하면 15분간의 혈류차단으로 혈관내피세포와 골격근의 병변을 확인할 수 있었고 지속적인 혈류차단은 자가포식(autophagy) 기전을 촉진시킨다고 하였다.
혈류차단에 이은 재 관류(reperfusion)는 모세혈관의 내피세포 및 골격근에 추가적으로 큰 손상을 입히게 된다[5,6]. 재 관류 시 생성되는 활성산소(ROS)와 호중구 백혈구(neutrophils)의 활성은 혈류차단-재관류 손상의 주된 요인이다[7]. 그 기전으로 재 관류 시 많은 양의 산소가 일시에 급격하게 유입됨으로써 유입된 산소가 superoxide (O2-), hydrogen peroxide (H2O2), hydroxyl radical (OH) 등으로 전환되어 산화적 스트레스를 증가시킨다[8]. 또한 azurophilic granule, specific granule, geltinase 또는 tertiary granule 및 secretory granule과 같은 호중구 백혈구의 축적 및 활성은 활성산소의 생성을 유도하며, 활성산소와 결합하여 다양한 염증반응을 일으킨다[7]. 많은 연구자들은 혈류차단에 의한 손상보다는 재 관류 시 생성되는 활성산소에 의한 산화적 스트레스 및 염증반응이 혈관내피세포, 뇌, 심장, 골격근 및 연부조직에 손상을 입히는 주요 원인이라고 보고하고 있다[9,10].
Ratchford et al. [11]은 슬관절 전치환술(total knee arthroplasty)을 실시한 환자들을 대상으로 2주의 회복기를 가진 후 수술을 위해 혈류차단을 시켰던 우측 대퇴사두근과 수술을 하지 않은 좌측 대퇴사두근의 근육량을 비교하였다. 2주 후 수술을 실시한 우측 대퇴사두근과 수술하지 않은 좌측 대퇴사두근은 각각 12%, 6%의 근육량 감소를 나타내었다. 또한 Hamacher-Brady et al. [12]은 혈류차단 후 재 관류 시 근위축(apoptosis) 요소인 muscle atrophy F-Box (MAFbx), muscle RING finger 1 (MuRF1) 및 Bcl2/adenovirus E1B 19 kDa protein-interacting protein 3 (Bnip3) 단백질 등의 증가를 보고하여 혈류차단-재 관류에 의한 골격근 단백질 분해 및 이화작용에 대한 결정적인 근거를 제시하고 있다. 혈류차단 시간에 따른 골격근의 손상에 관한 연구들은 2시간 15분 이상의 혈류차단은 골격근 기능에 치명적인 손상을 줄 수 있으며[13], 5시간 이상의 혈류차단은 골격근에 비가역적인 손상을 초래한다고 보고하고 있다[14].
혈류차단-재 관류에 관한 연구들이 보고되면서, 혈류차단-재 관류에 의한 손상을 줄이기 위해 약물처방, 고압산소처치 등 다양한 시도와 접근들이 이루어지고 있다[15,16]. 아직까지 혈류차단-재 관류에 의한 손상을 완전하게 억제하는 처치는 없었지만, 혈류차단 전 운동훈련에 의한 사전준비가 혈류차단-재 관류 시 나타나는 활성산소 및 염증반응에 효과적인 보호 작용(protective effect)을 한다는 연구들이 보고되고 있다[2]. Chen et al. [17]은 혈류제한 전 지구성 운동을 실시하면 항산화 능력이 증가되고 heat shock protein 활성이 증가되어 혈류차단-재 관류 손상에 대한 보호기전이 향상된다고 보고하였고, Seeger et al. [18]은 고강도의 인터벌 훈련에 의해 증가된 젖산이 골격근 손상의 보호역할을 하는 β-endorphins의 생성을 증가시켜 혈류차단-재 관류에 의한 골격근 손상지표가 감소되었다고 보고하였다. 그러나 응급상황과 같은 갑작스러운 수술 등 예고되어 있지 않은 혈류차단이 실시되는 경우 혈류차단-재 관류 손상을 최소화하기 위한 사후 방안들이 필요하다. 일반적으로 근육 좌상(muscle strain) 및 파열(rupture) 등과 같이 운동 중 발생되는 골격근의 손상들은 운동 후 신체활동을 통해 긍정적인 재활효과를 볼 수 있음이 잘 알려져 있다[19,20]. 그러나 혈류차단-재 관류 후 운동처치가 골격근의 손상에 미치는 연구로는 Walters et al. [2]은 혈류차단-재 관류 후 4주간 지속적인 신체활동을 실시한 집단이 혈류차단-재 관류 후 정적인 휴식을 취한 집단보다 근력이 증가되었음을 보고하였을 뿐 신체활동 증가에 의한 근력증가의 기전적 정보는 없으며, 특히 근 세포 수준에서 혈류차단-재 관류 시 근 세포 생성 메커니즘과 운동훈련의 형태가 혈류차단-재 관류 후 근세포 생성에 미치는 영향에 대한 연구는 전무하다.
골격근의 손상은 근 막에 존재하고 있는 위성세포(satellite cell)의 활성을 유도한다[21]. 위성세포는 골격근의 전구세포 또는 근육의 줄기세포라고 불리는 단핵세포로서 크게 대기/휴지기(quiescence), 증식(proliferation), 자가재생(self-renewal), 분화(differentiation)의 네 단계로 구분되며 각 단계마다 고유의 myogenic regulatory factors (MRFs – MyoD, Myf5, myogenin, and MRF4)들을 발현시킨다. 평상시 대기/휴지기 상태였던 위성세포(Pax7+MyoD-)는 근 손상이 일어나게 되면 다시 세포주기(cell cycle)로 들어가게 되어 MyoD, Myf5의 발현을 증가시켜 증식(Pax7+MyoD+)을 일으키게 된다. 증식된 위성세포는 Pax7 (paired box protein7)가 감소되고 Myogenin이 증가되면서 분화 프로그램(Pax7-MyoD+Myogenin+)으로 진행되어 근육의 요구에 따라 새로운 근 핵 또는 myotube로 분화되어 손상부위를 재생시키게 된다[22]. Pax7은 전사인자로서 위성세포의 증식 조절을 통하여 근육생성에 중요한 역할을 한다. 고강도 일회성 신장성 수축 운동시 회복기 24시간에 위성세포 수가 증가시키며[23], 성인 여성들을 대상으로 10주간 근력훈련을 실시한 결과 승모근의 위성세포 수가 증가하였고 저항성 운동훈련이 위성세포 수를 증가시키는 가장 효과적인 방법이라고 제시 하였다[24]. 또한 노인들을 대상으로 14주간 85-95%강도의 유산소 운동훈련을 실시한 후 외측광근의 위성세포 수가 유의하게 증가되었다[25]. 이와 같이 운동으로 유발되는 골격근의 손상 및 근 비대는 위성세포 수와 정적인 상관관계가 있음은 이미 다양한 연구에서 보고되었으며[26-29], 운동 형태, 강도 등 운동 방법에 따른 위성세포의 반응에 대한 연구들이 활발히 진행되고 있다[30]. 이와 같이 혈류차단-재 관류에 의한 골격근의 손상은 위성세포의 증식과 분화를 통하여 회복이 가능하며, 위성세포에서 발현되는 MRFs 단백질을 분석함으로써 위성세포의 증식과 분화 정도를 확인 할 수 있다.
따라서 이 연구는 관절 성형과 같은 정형외과 수술 및 다양한 혈류차단-재 관류에 의한 골격근 손상에 대한 효율적인 회복방법으로서의 운동훈련의 형태를 제시하려고 한다. 신체활동은 2주간의 저강도 지구성 및 저항성 운동훈련을 실시하였으며, 골격근의 손상 정도를 판단하기 위해 혈액 내 염증 지표인 Creatine kinase (CK)와 Lactate dehydrogenase (LDH)를 확인하였고, 혈류차단-재 관류 후 집단 별 처치에 대한 골격근의 재 생성 및 회복 정도는 근 재생 및 합성에 중요한 위성세포와 근 핵의 변화 등을 확인하였으며, 세포분열주기 단백질(MyoD, myogenin)의 발현 정도를 통하여 골격근의 증식 및 분화 정도를 분석하였다.
연구 방법
1. 연구 대상
이 연구에 사용된 실험동물은 10주령의 Sprague-Dawley 종 수컷 흰쥐이며, 유사한 형질을 나타내기 위하여 한배 암컷과 수컷을 동종 교배하였다. 총 21마리를 3개의 집단에 7마리씩 무선배정 하였으며, 그룹 별로 나누어 한 개의 cage에 2마리씩 배정하였다. 사육 환경은 온도(22±2℃), 습도(50-60%), 조명(12/12시간; light-dark cycle)을 유지하였으며, 탄수화물 67.5%, 지방 11.7%, 단백질 20.8%(Samtako, Korea)의 식이를 실시하였다. 실험동물은 한국체육대학교 동물실험윤리위원회로부터 승인(KNSU IACUC 2105-06)받은 후 실시하였다.
2. 혈류차단-재 관류 방법
연구에 사용된 쥐들은 3일간 안정 및 적응기를 가진 뒤 혈류차단-재 관류 수술을 실시하였다. 실험 쥐는 흡입마취제를 이용하여 마취시킨 후 수술부위인 복부와 왼다리 사이의 털을 제거한 뒤 절개하였다. 절개부위를 통하여 우측 온엉덩동맥(right common iliac artery)을 노출시키고 생쥐용 혈관집게(vascular clamp)로 2시간 동안 혈류를 차단하였다. 혈류가 차단된 동안은 수술부위가 마르지 않도록 생리식염수로 적신 멸균거즈를 처치하였고, 적절한 체온유지를 위해 항온패드를 사용하였다. 혈류차단 2시간 후 혈관집게를 제거하여 혈액을 재 관류 시킨 후 멸균된 suture kit를 이용하여 피부를 봉합하였다.
3. 실험설계
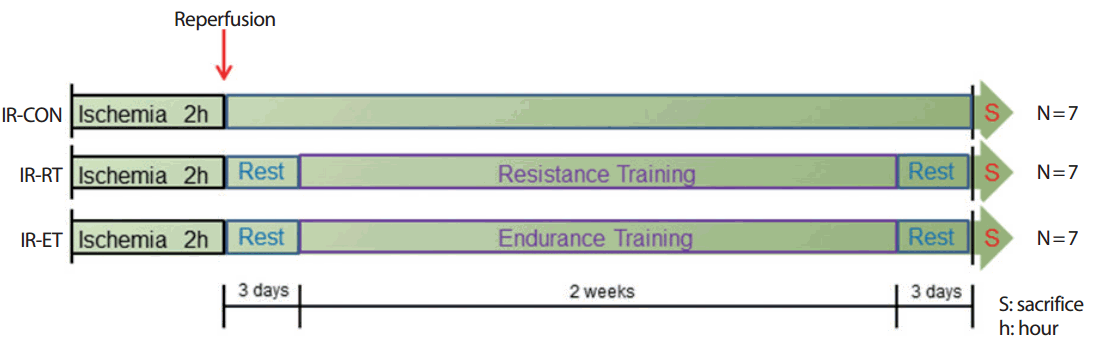
혈류차단-재 관류 수술을 받은 쥐들은 총 3개의 집단으로 무선배정하였다. 혈류차단-재 관류 후 초기 신체활동에 대한 효과를 파악하기 위하여 혈류차단-재 관류 후 2주간 정적인 휴식을 취하는 혈류차단-재 관류 대조집단(Ischemia-reperfusion control, IR-CON), 혈류차단-재 관류 후 2주간 저 강도의 저항성 운동훈련을 실시하는 혈류차단-재 관류 후 저항성 운동집단(Ischemia-reperfusion resistance training, IR-RT), 혈류차단-재 관류 후 2주간 저 강도의 유산소성 운동훈련을 실시하는 혈류차단-재 관류 후 유산소 운동집단(Ischemia-reperfusion endurance training, IR-RE)으로 설정하였다. 혈류차단-재 관류 수술 후 3일간의 회복기를 갖은 후 운동을 실시하였다. 위의 실험설계는 Fig. 1과 같다.
4. 운동훈련 방법
저항성 운동은 높이 1 m, 간격 2 cm, 경사 85°의 동물용 사다리를 이용하여 주 5회 실시하였다. 초기 1주일간은 추가적인 무게부하 없이 각 개체의 체중을 이용하여 주 5일, 30분간 12세트를 반복하였고, 다음 1주일간은 각 개체의 체중을 기준으로 50% 1RM의 무게를 꼬리에 달고 주 5회, 30분간 12회씩 실시하였다. Set 사이에는 사다리 가장 윗부분에 휴식공간을 마련하여 세트 간 2-3분의 안정적인 휴식을 실시하였다.
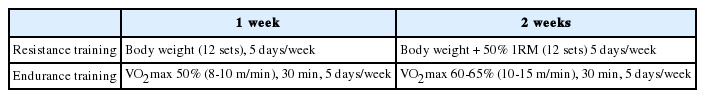
유산소성 운동훈련은 동물용 트레드밀(Rodent Treadmil, Daemyung Scientific Co, Ltd, Korea)을 이용하여 실시하였다. 총 2주간의 저 강도 유산소성 운동훈련을 실시하였으며 운동프로토콜은 Bedford et al. [31]의 연구를 참고하여 구성하였다. 초기 1주일간은 VO2max 50% (8-10 m/min)의 운동강도에서 주 5일 30분씩 실시하였고 다음 1주일간은 VO2max 60-65% (10-15 m/min)강도로 주 5일간 30분씩 실시하였다(Table 1).
5. 실험동물 희생 및 표본준비
2주간의 마지막 운동이 종료된 시점에서 마지막 운동의 영향을 최소화하기 위해 3일간의 안정기를 가진 후 실험동물을 희생하였다. 각 실험동물들은 이산화탄소(CO2)를 이용하여 마취시킨 뒤 혈액분석을 위하여 복대동맥(abdominal artery)에서 채혈하였다. 채혈된 혈액은 혈청과 혈장 처리용 튜브에 나눠 담아 10분간 3,000 rpm에서 원심 분리하여 상층액 만을 옮겨 담았다. 혈청 분리용 튜브는 상온에서 30분 이상 응고처리 과정을 거쳤으며 모든 상층액은 분석에 사용될 때까지 -80℃에서 보관하였다. 각 개체는 골격근의 특성에 따른 손상, 재생 및 회복 정도를 파악하기 위하여 가자미근(soleus muscle, SOL)과 장지신근(extensor digitorum longus muscle, EDL)을 샘플링 하였다. 적출된 샘플들은 현미경을 이용한 표현형(phenotype) 분석을 위해 O.C.T compound (Tissue-Tek; Sakura Finetek Europe, Zoeterwoude, The Netherlands)로 전 처리 하였고, 조직 내 단백질 분석을 위해 액화질소에 급속 냉동시켜 분석이 이루어 질 때까지 -80℃에서 보관하였다.
6. 혈액분석
집단 별 처치에 따른 근 손상 및 염증 정도를 파악하기 위하여 혈중 Creatin Kinase (CK)와 Lactate Dehydrogenase (LDH) 분석을 실시하였다. 혈액 분석은 Modular Analytics (Roche, Germany)를 이용한 UV assay 방법으로 분석하였다.
7. Western blot analysis
-80℃에서 보관되었던 근육 조직에 lysis buffer [25 mM Tris-Cl (ph 7.5), 250 mM NaCl, 5 mM EDTA, 1% NP-40, 1 mM phenymethylsulfony1 fluoride (PMSF), 5 mM dithiothreitol (DTT)]를 분주하여 4℃에서 overnight 시킨 뒤 4℃가 유지된 상태에서 14,000 rpm으로 30분간 원심분리 하였다. 옮겨진 상층액(total cytosol fraction)을 정량하여 2X SDS loading buffer (60 mM tris pH6.8, 25% glycerol, 2% SDS, 14.4 mM 2-mercaptoethanol, 0.1% Bromophennol Blue)를 첨가한 후 10% seperating gel (30% acrylamide, 1.5M tris pH8.8, 10% Ammonium persulfate, TEMED)과 5% stacking gel (30% acrylamide, 1M tris pH6.8, 10% Ammonium persulfate, TEMED)을 조성하여 분주하였으며, 스탠다드 마커(SDS-PAGE Molecular Weight Standard, BioRad)와 함께 각 샘플들이 바닥에 닿을 때까지 80 Volt에서 전기영동을 실시하였다.
Nitrocellulose Blotting Membrane (Life science, Germany)과 Transfer buffer (190 mM glycine, 50 mM Tris-base, 0.05% SDS, 20% methanol), 3M paper (Whatman)를 순서대로 겹쳐 80 volt로 1시간 30분 동안 전사하여 Membrane으로의 단백질 이동을 완료한다. 단백질 증착이 완료된 membrane은 1시간 30분 동안 4% BSA 용액(10 mM Tris-base, HCl-pH7.6, 0.5 M NaCl, 0.05% Tween20)으로 Blocking 시킨 후 1차 항체인 MyoD (sc-71629, Santa Cruz, CAL, USA), myogenin (sc-12732, Santa Cruz, CAL, USA)을 blocking 용액과 1:1,000의 농도로 12시간 동안 incubation 시켰다. 1차 안티바디 incubation이 마쳐지면 TBS-T 용액으로 10분간 3회 washing한 후 짝이 맞는 2차 항체를 4% skim milk용액과 1:5,000의 농도로 1시간 30분 동안 incubation 시켰다. 마지막으로 TBS-T용액을 이용하여 10분간 3회 washing을 실시한 후 WBLR solution (Luminata Crescendo Western HRP Substrate, Millipole, USA)으로 단백질을 발광시켜 이미지 분석 시스템(Molecular Imager Chemi-Doc XRS System, Bio-Rad, USA)으로 스캔한 후 각 표본의 단백질량을 산출하였다(Quantity One 1-D Analysis Software, Bio-Rad, USA).
8. Immunohistochemistry analysis
O.C.T compound 처리된 조직은 microtome (Leica, Germany)에서 -20℃를 유지한 채 10 μm의 두께로 cryo-cut하여 slide glass에 옮긴 뒤 4% PFA용액으로 5분간 고정시켰다. 조직 내 기름 성분을 제거하기 위하여 미리 -20℃에 보관 중이었던 메탄올에 10분간 담근 후 donkey serum과 0.1% triton/PBS를 9:1로 섞어 만든 blocking용액에 20분간 blocking 시켰다. 위성세포의 염색을 위해 1차 항체인 Pax7 (MAB 1675, R&D system, USA)과 anti-Laminin (L9393, Sigma, USA)을 1% BSA/TPBS 용액과 1:100으로 혼합하여 조직에 분주한 뒤 4℃에서 12시간 이상 overnight 시켰다. 1차 항체의 incubation이 마쳐지면 0.1%triton/PBS를 이용하여 10분간 3회 washing을 하고, 짝이 맞는 2차 항체를 1% BSA/TPBS에 1:500으로 희석시켜 상온(20-25℃)에서 4시간 동안 빛을 차단한 채 incubation 시켰다. 마지막으로 0.1%triton/PBS로 10분간 3회 washing한 후 근 핵의 염색을 위하여 4, 6-diamidino-2-phenylindole (DAPI)염료가 포함되어 있는 mounting medium (H-1200, Vector Laboratories)을 분주한 뒤 cover glass로 고정시켰다. 고정된 조직들은 Leica TCS SP8 confocal microscope (Leica microsystem, Germany)를 이용하여 이미지화하였다.
9. 자료처리 및 통계
얻어진 결과들은 SPSS/PASW statics 18 버전 통계 프로그램을 사용하여 평균과 표준편차를 산출한 뒤 집단(IR-CON, IR-RT, IR-ET) 간 차이를 검증하기 위해 일원변량분석(one-way ANOVA)을 실시하였다. 사후 검정은 Tukey HSD 방법을 사용하였고 모든 검증의 통계적 유의수준은 α=.05로 설정하였다.
연구 결과
1. 체중 및 근육량의 변화
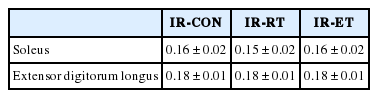
실험동물의 혈류차단과 재 관류 후 혈류차단-재 관류 후 2주간 처치하지 않은 대조집단(IR-CON; 388.1±20.05 g), 혈류차단-재 관류 후 2주간 저항성운동 훈련 집단(IR-RT; 392.6±15.20 g), 혈류차단-재 관류 후 2주간 유산소성 운동 훈련 집단(IR-ET 집단; 404.3±18.82 g) 간 체중의 차이는 없었으며, 집단 간 근육량(가자미근 및 장지신근)에도 차이가 없었다(Table 2).
2. 혈중 CK 및 LDH 농도
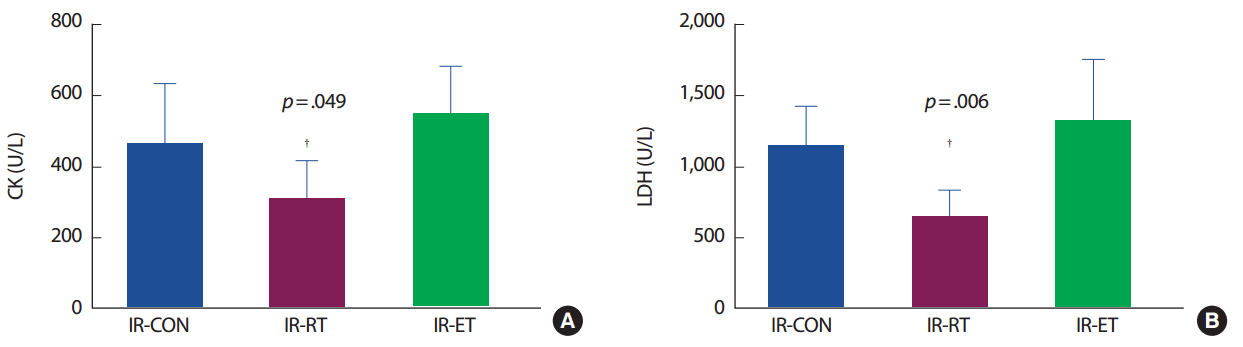
혈중 CK 농도는 IR-CON 집단에 비해 IR-RT 집단이 66.1% 낮았으나(p< .05), IR-ET 집단은 IR-CON 집단과 차이가 없었다. 혈중 LDH 농도도 CK 농도와 같은 경향으로 IR-CON 집단에 비해 IR-RT 집단이 55.5% 낮았으나(p< .05) IR-ET 집단은 IR-CON 집단과 차이가 없었다(Fig. 2).
3. 근세포의 면적
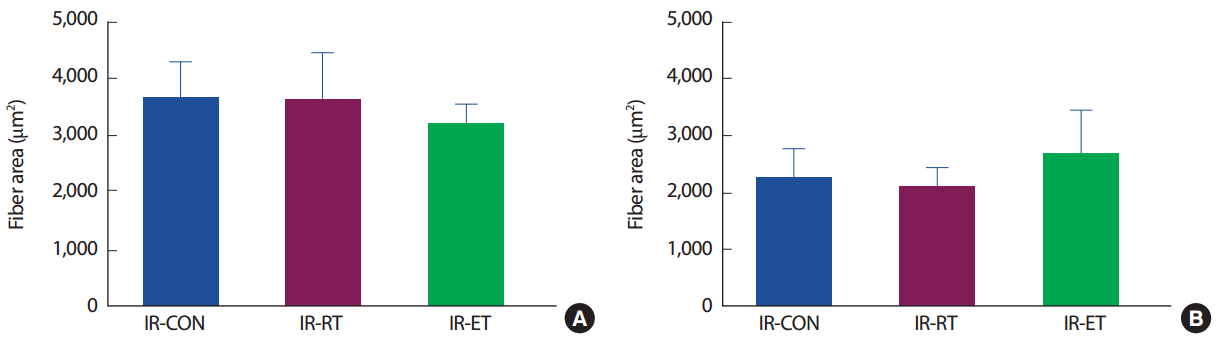
가자미근(SOL)의 근세포 면적은 IR-CON 집단(3,713.0±559.8 µm2), IR-RT 집단(3,658.5±775.7 µm2) 및 IR-ET 집단(3,250.7±291.6 µm2) 간에 차이가 없었다(p>.05). 장지신근(EDL)의 근세포 면적은 IR-CON 집단(2,277.2±480.8 µm2), IR-RT 집단(2,125.5±302.9 µm2) 및 IR-ET 집단(2,715.7±733.3 µm2) 간에 차이가 없었다(p>.05) (Fig. 3).
4. 위성세포(Satellite cells)
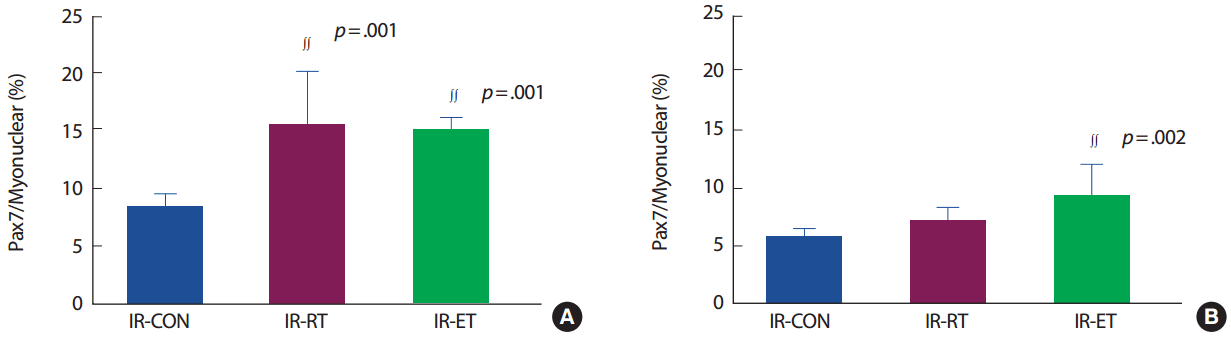
가자미근의 근섬유 당 위성세포의 수(Pax7/fiber)는 IR-CON 집단에 비해 IR-RT 집단(187%, p< .005)과 IR-ET 집단(187.5%, p< .005)에서 발현이 높았으나 IR-RT 집단과 IR-ET 집단 간의 차이는 없었다. 장지신근의 Pax7/fiber는 IR-CON 집단에 비해 IR-RT 집단(116.6%, p>.05)은 차이가 없었으나 IR-ET 집단은 IR-CON 집단에 비해(150%, p< .05)에서 발현이 높았다. 그러나 IR-RT 집단과 R-ET 집단 간의 차이는 없었다(p>.05) (Fig. 4).
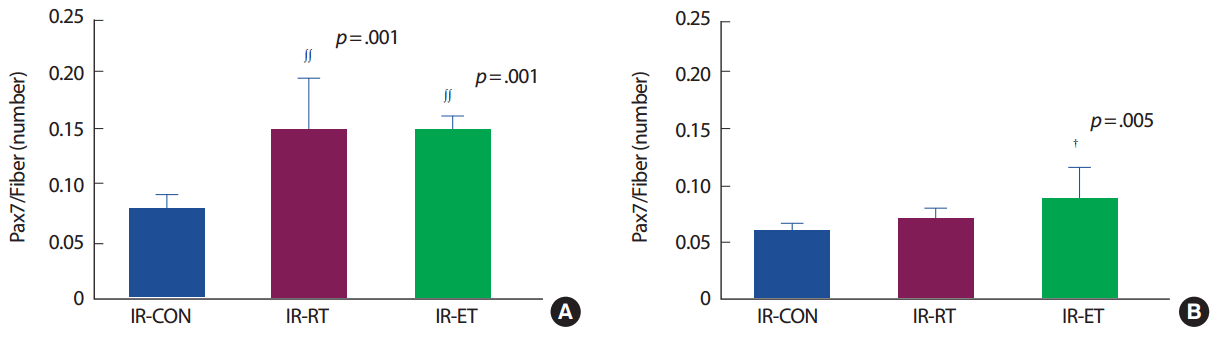
Quiescence satellite cell (Pax7/fiber) number of SOL (A) and EDL (B). IR-CON, ischemia-reperfusion control; IR-RT, resistance training after ischemiareperfusion; IR-ET, endurance training after ischemia-reperfusion. ∫∫p<.005, significantly difference from IR-CON, †p<.05, significantly difference from IR-CON.
가자미근의 단위면적 당 위성세포 수(Pax7/area)는 IR-CON 집단에 비해 IR-RT 집단(184.4%, p< .005)과 IR-ET 집단(201.9%, p< .005)에서 발현이 높았으나 IR-RT 집단과 IR-ET 집단 간의 차이는 없었다(p>.05). 장지신근의 Pax7/area는 IR-CON 집단과 IR-RT 집단 및 R-ET 집단 간의 발현에 차이가 없었으며(p>.05), IR-RT 집단과 IR-ET 집단 간에도 차이는 없었다(p>.05) (Fig. 5).
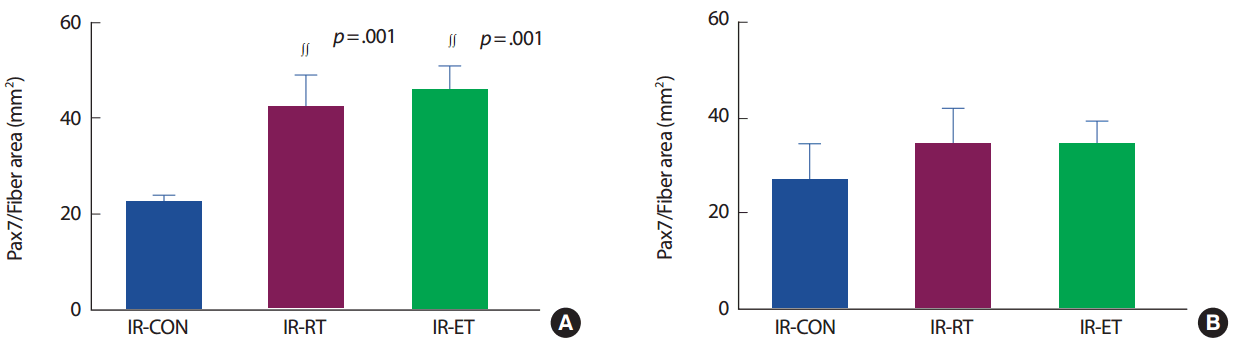
Pax7 domain (Pax7/fiber area) of SOL (A) and EDL (B). IR-CON, ischemia-reperfusion control; IR-RT, resistance training after ischemia-reperfusion; IR-ET, endurance training after ischemia-reperfusion. ∫∫p<.005, significantly difference from IR-CON.
가지미근의 근핵 당 위성세포의 수(Pax7/myonuclear)는 IR-CON 집단에 비해 IR-RT 집단(183%, p< .005)과 IR-ET 집단(176%, p< .005)에서 발현이 높았으나 IR-RT 집단과 R-ET 집단 간의 차이는 없었다. 장지신근의 Pax7/myonuclear는 IR-CON 집단에 비해 IR-RT 집단(123.4%, p>.05)은 차이가 없었으나, IR-ET 집단은 IR-CON 집단에 비해(123.4%, p< .005) 발현이 높았다. 그러나 IR-RT 집단과 R-ET 집단 간의 차이는 없었다(p>.05) (Fig. 6).
5. 근핵(Myonuclear)
가자미근의 근섬유 당 근핵의 수(myonuclear/fiber)는 IR-CON 집단에 비해 IR-RT 집단(142.6%, p< .005)과 IR-ET 집단(127.8%. p< .05)에서 발현이 높았으나 IR-RT 집단과 IR-ET 집단 간의 차이는 없었다. 장지신근의 myonuclear/fiber는 IR-CON 집단과 IR-RT 집단 및 IR-ET 집단의 발현 간에 차이가 없었으며(p>.05), IR-RT 집단과 IR-ET 집단 간에도 차이는 없었다(p>.05)(Fig. 7).

Myonuclear number (myonuclear/fiber) of SOL (A) an EDL (B). IR-CON, ischemia-reperfusion control; IR-RT, resistance training after ischemia-reperfusion; IR-ET, endurance training after ischemia-reperfusion. ∫∫p<.005, significantly difference from IR-CON, †p<.05, significantly difference from IR-CON.
가자미근의 근핵 당 근섬유의 면적(fiber area/myonuclear)은 IR-CON 집단에 비해 IR-RT 집단(69.9%, p < .005)과 IR-ET 집단(69.5%, p< .005)에서 발현이 낮았으며 IR-RT 집단과 IR-ET 집단 간에도 차이는 없었다(p>.05). 장지신근의 fiber area/myonuclear은 IR-CON 집단과 IR-RT 집단 및 R-ET 집단의 발현 간에 차이가 없었으며(p>.05), IR-RT 집단과 R-ET 집단 간에도 차이가 없었다(p>.05) (Fig. 8). 근핵이 세포 가운데 위치한 근 섬유 수(Fiber with central nuclear)는 근섬유 종류 및 실험조건 간에도 차이가 없었다(p>.05) (Fig. 9).
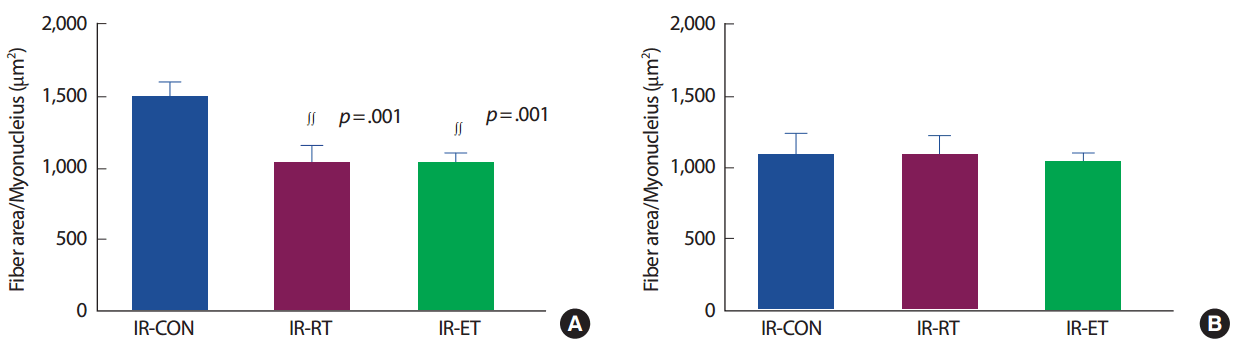
Myonuclear domain (fiber area/myonuclear) of SOL (A) and EDL (B). IR-CON, ischemia-reperfusion control; IR-RT, resistance training after ischemia-reperfusion; IR-ET, endurance training after ischemia-reperfusion. ∫∫p<.005, significantly difference from IR-CON.

Central nuclei of SOL (A) and EDL (B). IR-CON, ischemia-reperfusion control; IR-RT, resistance training after ischemia-reperfusion; IR-ET, endurance training after ischemia-reperfusion.
위의 Immunohistochemistry 실험방법을 이용한 표현형(phenotype) 분석은 Fig. 10과 같은 이미지를 이용하여 200개 이상의 근섬유를 분석하였다.
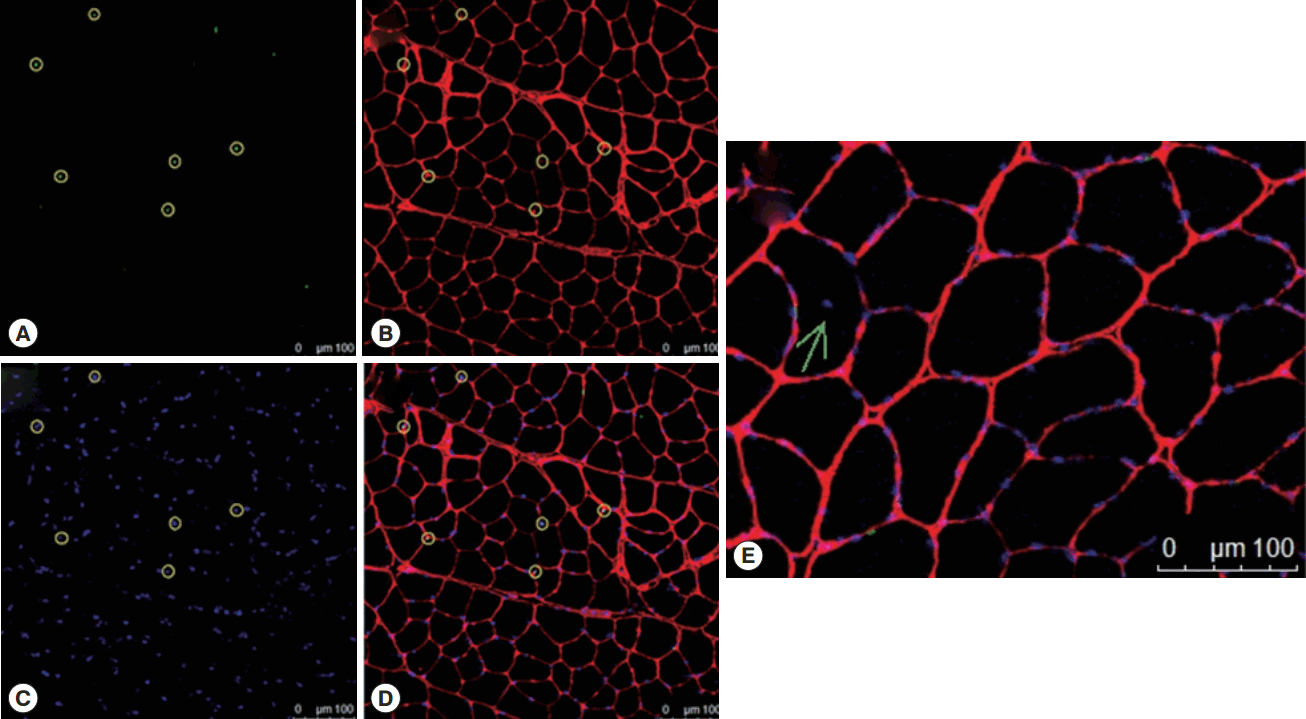
Immunohistochemistry imagine for analysis. (A) is quiescence satellite cell, green, (B) is laminin for distinguishing the single fiber, red, (C) is nuclei, blue and (D) is merged with (A), (B), and (C). Yellow circles are satellite cells which are overlap with green and blue dot completely. (E) shows central nuclei, green arrow.
6. MyoD, Myogenin 단백질의 발현
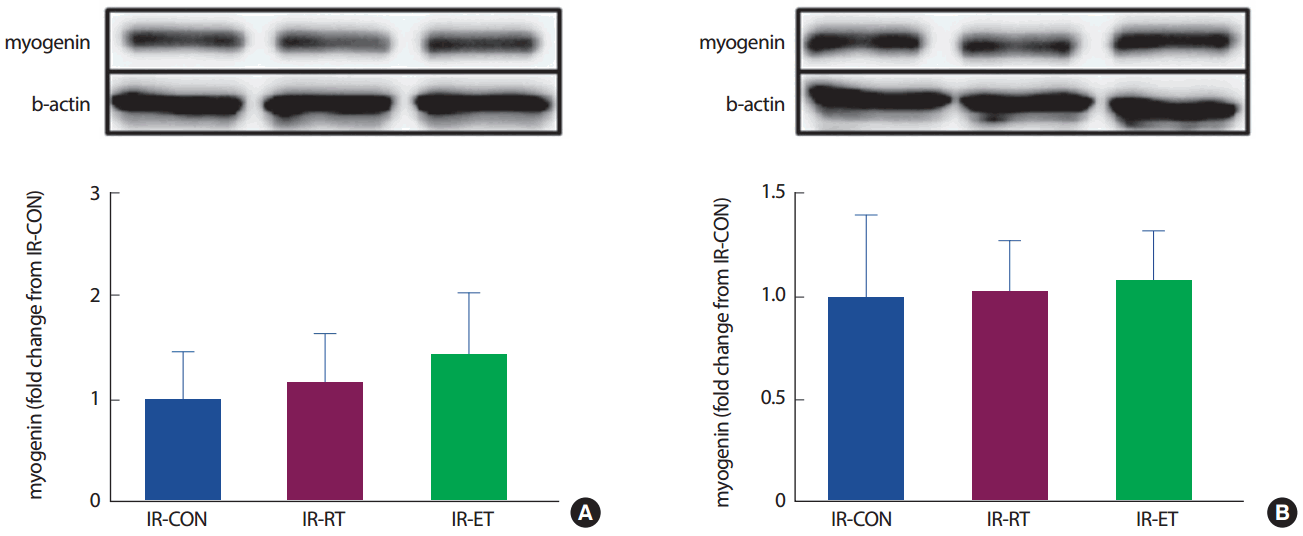
가자미근의 MyoD 단백질의 발현은 IR-CON 집단에 비해 IR-RT 집단이 차이가 없었으나(131%, p< .05), IR-ET 집단은 IR-CON 집단에 비해 MyoD 발현이 165% 높았다(p< .05). 장지신근의 MyoD 단백질의 발현도 가자미근의 MyoD 단백질 발현과 같은 경향으로 IR-CON 집단에 비해 IR-RT 집단이 차이가 없었으나(106%, p < .05), IR-ET 집단이 IR-CON 집단에 비해 174% 높았다(p< .05) (Fig. 11). 두 근육(가자미근, 장지신근) 모두 myogenin 단백질의 발현에는 집단 간 차이가 없었다 (p>.05) (Fig. 12).
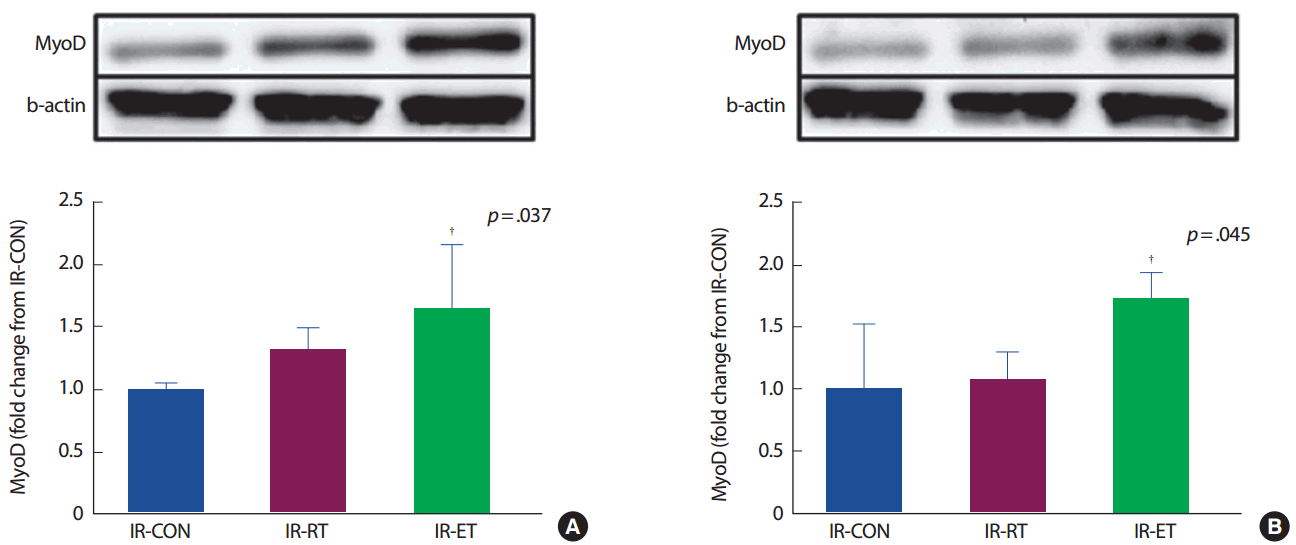
MyoD expression in protein level of SOL (A) and EDL (B). IR-CON, ischemia-reperfusion control; IR-RT, resistance training after ischemia-reperfusion; IR-ET, endurance training after ischemia-reperfusion. †p<.05, significantly difference from IR-CON.
논 의
이 연구의 주요 결과는 혈류차단-재 관류 후 2주간의 유산소 운동과 저항성 운동훈련이 혈류차단-재 관류 대조집단에 비해 위성세포의 활성화 및 위성세포의 증식이 증가하였으며 근 세포 재생 과정에 긍정적인 영향을 미쳤다.
혈류의 차단은 차단 시간과는 관계없이 혈류공급이 제한된 직후 조직의 생리학적, 생화학적, 면역학적 변화를 유도하여 혈관내피세포, 근섬유 등 다양한 조직에 손상을 초래하게 된다. 또한 혈류차단 후 재 관류 시 일시에 급격하게 산소가 유입이 되면서 nitric oxide (NO), inflammatory cytokine, reactive oxygen species (ROS) 등을 생성하여 골격근 및 주변 조직들의 심각한 손상을 입히게 된다[31-34]. Vignaud et al. [35]은 2시간 이상 지속된 혈류차단-재 관류 시 근섬유 사멸 등 심각한 골격근 손상이 나타난다고 하였다. 따라서 다양한 환경, 수술, 질병 등에 의해 발생되는 혈류차단-재 관류 손상(IR injury)에 대한 예방 및 치료적 접근 방법 등에 대한 연구가 필요하다.
혈류차단-재 관류 후 2주간의 유산소성 운동훈련과 저항성 운동훈련은 IR-CON 집단보다 운동훈련 집단에서 위성세포의 수가 유의하게 증가되었다(Fig. 4). 위성세포는 근섬유의 근초(sarcolemma)와 기저막(basal lamina) 사이에 위치해 근육의 성장, 회복 및 재생에 필수적인 역할을 담당하는 단핵 구조의 근육 줄기 세포이다. 일반적으로 위성세포는 대기/휴지기(quiescence) 상태로 존재하고 있지만 운동이나 근육 손상과 같은 외부자극에 의하여 활성(activation)된다. 활성화된 위성세포는 세포분열을 통하여 딸 세포(daughter cell)를 만들어 세포가 증식(proliferation)되며, 증식에 의해 증가된 위성세포는 근 손상에 대한 회복이나 단백질 합성에 의한 근 비대 등 필요에 따라 새로운 근섬유 또는 근 핵으로 분화(differentiation)되거나 다시 대기/휴지기 상태로 돌아가게 된다(self-renewal) [36]. 이와 같이 위성세포는 대기, 활성, 증식, 분화의 4가지 상태를 거치며 성장기가 끝난 근섬유의 세포주기를 재 활성화시켜 골격근의 성장 및 재생을 유도하게 된다[21,37,38]. Verdijk et al. [39]은 근육의 성장과 위축에 대한 연구에서 노화 시 Type Ⅱ 섬유의 위성세포 수의 감소가 TypeⅡ 섬유 크기의 감소와 정적인 상관이 있으며, 노화로 인한 근세포 횡단면적의 감소는 위성세포 수의 감소에 의한 결과임을 제시하였다. 따라서 혈류차단-재 관류 후 2주간의 운동훈련에 의해 위성세포 수의 증가는 손상된 근육의 회복 및 재생과 관련이 있다.
위성세포는 세포주기에 따라 MyoD, myogenin, Myf5, MRF4로 구성된 Myogenic regulator factors (MRFs)를 발현시킨다[22]. MRFs 중 MyoD는 근세포 발달의 초기과정에 발현되는 증식단계의 대표 단백질로서 대기/휴지기 상태의 위성세포에서는 거의 측정되지 않을 정도로 매우 낮은 발현이 나타나지만 운동이나 근육조직의 손상 등에 의해 그 발현이 활성화된다. Myogenin은 근 생성의 분화과정 동안 전구세포가 새로운 세포로 분화되거나 기존의 근 섬유에 융합하는데 중요한 역할을 한다[40]. 혈류차단-재 관류 후 2주간의 유산소성 운동훈련은 대부분의 근섬유가 유산소성 특성을 지닌 가자미근(SOL)과 해당성 특성을 지닌 장지신근(EDL)의 MyoD 단백질 발현량이 IR-CON집단에 비해 IR-ET 집단에서 유의하게 증가되었고 IR-RT 집단에서는 차이가 없었다(Fig. 11). 그러나 myogenin의 단백질 발현은 각 집단 모두 IR-CON 집단과 차이가 없었으며 운동처치 집단 간에도 차이가 없었다(Fig. 12). 뿐만 아니라 근 손상 후 2-3일의 시간이 경과하게 되면 위성세포 분화를 의한 근아세포(myoblast)의 합성이 일어나며, 새롭게 생성된 근 핵이 세포중앙에 위치(central nuclei)하다가 점차적으로 근 세포의 기저막 부위로 이동하게 되는데[21,41,42], 이 연구의 결과에서 보는 바와 같이 수축특성이 다른 근육 및 운동훈련 간에도 세포 중심에 위치하는 위성세포의 증식에 유의한 차이는 없는 것으로 나타났다(Fig. 9). 이는 혈류차단-재 관류 후 2주간의 유산소성 운동훈련이 위성세포의 분화보다는 증식에 효과적으로 작용하고 있으며, 근섬유의 수축특성과는 상관이 없음을 예측할 수 있다. 그러나 근섬유 당 근 핵 수(myonuclear/fiber)를 비교했을 때 SOL에서 두 운동훈련 집단 모두 IR-CON 집단에 비해 유의하게 근 핵의 수가 증가되었으며(Fig. 7), 이는 운동훈련이 위성세포의 분화를 유도하여 혈류차단-재 관류로 인한 손상된 세포의 재생에 기여하고 있음을 확인할 수 있다. 이러한 결과는 IR-CON 집단에 대한 운동훈련 집단의 근 핵 당 위성세포 수(Pax7/myonuclear)와 근세포의 횡단면적의 변화(Fig. 3)를 고려 할 때 근 세포의 분화에 의한 근 세포의 성장이나 비대보다는 근세포의 재생에 기여하는 것을 확인할 수 있다(Fig. 6). 따라서 혈류차단-재 관류 후 2주간의 유산소성 운동훈련에 의해 증식된 위성세포는 근 핵이나 새로운 근섬유로의 분화보다는 근 세포의 재생을 위한 self-renewal에 기여했을 가능성이 크다.
혈류차단-재 관류 후 2주간의 운동훈련은 유산소성 운동훈련과 저항성 운동훈련 시 SOL의 위성세포 수와 근 핵 수 모두 유의한 증가를 유도하였다. 하지만 EDL에서는 유산소성 운동훈련에 의해 위성세포의 수는 증가되었으나 근 핵의 변화에는 차이가 없었다. 혈류차단-재 관류 후 2주간의 운동훈련은 SOL이 EDL에 비해 근 세포의 성장이나 재생에 민감하게 반응하며, 이는 SOL의 항 중력 능력이 EDL보다 큰 근섬유의 특성에 따른 운동훈련의 영향이 나타난 결과로 해석된다. 그럼에도 불구하고, 근육의 손상지표로서 고강도 운동시 증가되는 LDH와 CK의 농도가 저항성 운동훈련 후 유산소 운동훈련의 농도보다 낮게 나타난 결과(Fig. 2)를 고려해 볼 때 저항성 운동훈련의 강도가 유산소 운동 훈련의 강도에 미치지 못했을 가능성 역시 배제 하지 못한다[43]. 혈류차단-재 관류 후 2주간의 운동훈련 시 SOL이 EDL 보다 발현의 정도가 큰 또 다른 가능성으로는 안정 시에도 근 핵의 발현이지 근성 섬유가 속근성 섬유에 비해 높다는 것이다. Willkomm et al. [44] 의 연구에 의하면 TypeⅠ섬유가 TypeⅡ섬유에 비해 위성세포의 반응이 활발함을 보고하고 있는데 이는 TypeⅠ섬유가 유산소 대사가 활발하고 이에 따라 생성되는 reactive oxygen species (ROS)의 활성이 높아 ROS에 의해 TypeⅡ보다 많은 위성세포의 활성을 유도한다고 설명하고 있다. 또한 근섬유 특성에 따른 위성세포 수의 차이에 의한 영향도 고려할 수 있다. Mackey et al. [45]은 근육의 특성에 따른 위성세포의 수를 조사한 결과, TypeⅠ섬유가 TypeⅡ섬유에 비해 위성세포 수가 많은 것으로 보고하였다. 이 연구의 IR-CON의 위성세포 수에 있어서 SOL이 EDL에 비해 133% 정도 많은 결과를 고려 할 때, 이 연구의 근육의 수축특성에 따른 위성세포 발현의 차이는 혈류차단-재 관류 후 2주간의 운동훈련의 특성에 의한 차이일 가능성도 있지만 근육의 수축특성에 따른 위성세포 수의 차이에 따라 증식 및 분화에 기여하는 위성세포의 수에 의한 차이가 있을 가능성도 배제 할 수 없다.
그러나 이 연구의 제한 점으로써 골격근 수축단백질의 합성에 영향을 미치는 유산소 운동 강도와 근육훈련의 강도를 동일하게 적용하지 못한 것과 혈류차단-재 관류를 실시하지 않은 집단이 없었다는 점은 이 연구의 제한점이 될 수 있다. 따라서 혈류차단-재 관류 후 운동훈련의 형태나 운동 강도 등의 보다 구체적이고 객관화 될 수 있는 실험설계에 의한 운동훈련이 근 세포의 성장과 재생에 미치는 영향에 관련된 후속적인 연구가 필요하다.
결 론
종합해보면 혈류차단-재 관류 후 2주간의 유산소성 운동훈련과 저항성 운동훈련은 근섬유 특성에 따른 반응의 정도는 다르지만 운동훈련은 위성세포의 수를 증가 시키고 근 핵을 증가시킴으로써 혈류차단-재 관류에 의한 근 세포의 손상의 재생에 관여할 것으로 생각되며, 운동훈련은 운동의 형태에 상관없이 근 세포의 성장 및 재생 과정에 긍정적인 영향을 미칠 것으로 사료된다.