고지방식이로 유도된 비만 마우스의 지방조직에서 일회성 운동이 대식세포 표현형 비율 변화에 미치는 영향
Effects of a Single of Bout Exercise on the Macrophage Phenotypic Ratio in the Adipose Tissue of High-Fat Diet-Induced Obese Mice
Article information
Trans Abstract
PURPOSE
Exercise in known to inhibit M1 macrophage (M1ф) differentiation, and increase in M2 macrophage (M2ф) and inhibition of M1ф in adipose tissue are known to reduce obesity. However, studies on the effects of exercise are very limited and it has not yet confirmed whether the polarization of M1ф/M2ф actually changes. Therefore, I tried to confirm the M1ф/M2ф polarization in the real change in single bout of exercise.
METHODS
Male C57BL/6 mice were divided into four groups; normal diet (ND) control (n=7), ND exercise (n=7), high-fat diet (HFD) control (n=7), and HFD exercise (n=7) groups. All exercise mice ran on a treadmill at 15 m/min for 60 minutes for single bout. All animals were sacrificed two hours after single-bout of exercise and adipose tissue was isolated. Adipocytes were extracted from isolated adipose tissue and FACS was performed.
RESULTS
Single bout of exercise in high-fat diet induced obese mice did not actually increase M2ф polarization in adipose tissue. Rather, the expression of M1ф was significantly higher than that of the other groups. However, expression of M2ф-related genes (Arg1) was highest in HFD-EX compared to ND control and HFD control.
CONCLUSIONS
Despite the increase of M1ф due to obesity, the expression of M2ф-related gene Arg1 was found to be increased by exercise regardless of the high-fat diet. These results suggest for the first time that a single bout of exercise can independently affect the change in M1ф/M2ф phenotypic ratio regardless of obesity or high-fat diet.
서 론
전 세계의 11% 이상이 비만이며 이 수치는 급속이 증가하고 있다. 비만만으로는 문제가 되지 않지만 고지혈증[1], 고혈압[2], 죽상동맥경화증[3], 당뇨병 및 비알코올성 지방간과 같은 2차적인 합병증은 대체로 비만으로 인한 것이다[4-6].
약물치료나 수술적 요법을 제외한 비만 치료는 운동과 식이 조절을 통한 체지방의 감소를 목표로 한다. 최근에는 비만을 개선시키기 위하여 면역학적인 연구가 활성화되고 있다. 여러 연구에 따르면 비만은 만성 염증이 동반되며 면역 세포와 다른 세포에서 전신과 조직 특이적인 염증 반응에 커다란 영향을 미칠 수 있다고 보고되었다[7,8]. 또한 비만은 아동기에 후천면역(acquired immunity)과 관련된 각종 항체생성을 저하시킨다고도 보고되기도 하였다[9]. 또한 비만은 여러 사이토카인(cytokine) 및 케모카인(chemokine)의 발현에 영향을 미치는 것으로 알려져 있다[10-13]. 만성 및 내인성 특징을 지닌 비만 관련 염증은 일반적인 염증 반응과는 다르다. 이러한 염증 반응에는 대식세포(macrophage), 수지상세포(dendritic cell) 그리고 T 세포 및 B 세포가 포함된다[14,15]. 특히, 비만 환자는 M1 대식세포(M1ф)[16,17], Th1 (T helper 1) 세포 및 세포 독성 T (CTL) 세포가 비정상적으로 증가되어 있고[18], Th2 및 Treg (regulatory T) 세포가 감소되어 있다[18,19]. 따라서, 비정상적인 면역계를 조절함으로써 비만이 개선될 수 있다고 제안하고 있다.
같은 맥락에서 M2 대식세포(M2ф), Th2 (T helper 2) CD4 (cluster of differentiation)+T 세포, Treg 세포, 호산구(eosinophil) 및 선천성 림프구(innate lymphoid) 세포는 적절한 운동에 의하여 증가할 수 있으며, 비정상적으로 증가된 M1ф, Th1, Th17 (T helper 17) 및 CTL을 정상수치로 낮추어 면역학적인 항상성을 유지시킬 수 있다[20]. 따라서 비만 치료에 대한 운동의 효과는 칼로리 소모를 통한 부정적 에너지 균형과 신진대사의 활성화뿐 아니라 면역체계의 정상화와 커다란 관련이 있는 것으로 생각된다. 운동을 통한 면역체계의 정상화와 활성화는 세포전달물질의 작용이 전신의 지방조직까지 미치게 하여 지방분해를 촉진하게 된다[21]. 즉, 운동을 통해 면역계가 활성화되고 M1ф/M2ф의 적절한 비율 변화가 동반되면 세포전달물질의 작용이 원활해지고 전신의 지방조직의 지방분해를 촉진하게 됨으로써 비만의 개선에 효과적일 수 있다. 이러한 작용은 면역체계의 정상화와 대식세포의 비율 변화를 통해 비만의 개선에 긍정적인 영향을 미칠 수 있다는 것을 의미하며, 비만을 개선하기 위한 면역학적 접근의 핵심 논리이다.
비만의 개선을 위한 면역학적 접근의 핵심 논리를 입증하기 위하여 많은 연구가 이루어졌으며 지방조직에서 M1ф/M2ф 비율에 대한 연구는 장기간의 운동을 통해 mRNA 수준에서 M2ф의 발현이 증가함을 보여주었다[22]. 연구 결과는 장기간의 운동을 통한 M1ф에서 M2ф로의 표현형 비율 전환을 통해 지방조직에서 대식세포의 비율을 효과적으로 조절할 수 있다는 것을 입증하였다. 이러한 장기간의 운동의 만성적인 운동의 효과는 항염증 효과와 인슐린 신호 전달 및 민감도가 향상되기 때문에 신체 활동이 인슐린 저항성 치료에 유용한 방법이 될 수 있다는 사실이 입증되었다[23-25]. 또한 최근의 연구에서는 급성운동 프로토콜을 이용한 비만 랫드(rat)의 toll-like receptor 4 (TLR4) 신호 전달 경로를 둔화시켜 백색지방조직(white adipose tissue, WAT)의 염증을 감소시켰음을 확인하였다[26]. 그리고 해당 연구에서 운동은 WAT에서 항염증 효과가 있음을 보여주었다. 마찬가지로 CD68 및 CD14의 발현 감소, 대식세포 특이적 지표에 의해 동물에서 입증된 사실들이 사람에서도 확인되었다[23]. 이러한 사실을 바탕으로 수행된 일회성 운동 연구에서는 일회성 운동만으로도 인터루킨-10(IL-10)의 발현 증가로 표현형 비율변화를 가져올 수 있다고 제안되었다[27]. 하지만 비만동물이나 비만인을 대상으로 운동을 통해 지방조직에서의 M1ф/M2ф의 비율 변화로 비만개선을 가져올 수 있음에도 불구하고 관련된 논문은 최근의 종설 논문에서도 언급하고 있을 정도로 부족한 실정이다[28].
지방조직에서 M1ф/M2ф 비율 변화와 관련된 여러 연구들은 면역학적인 접근의 핵심을 어느 정도 입증하였다. 장기간의 운동과 관련된 지방조직에서의 M1ф/M2ф 비율 변화 관련 연구에서는 다양한 분자생물학적인 기법 중 real-time PCR (qPCR) 결과로 도출된 mRNA 수준에서의 대식세포 관련 유전자의 발현 차이를 확인하였고, 이를 통해 M1ф에서 M2ф로의 표현형 변화가 일어날 수 있다고 제안하였다[29]. Oliveira와 그의 동료들의 일회성 운동 관련 연구에서는 western blot을 이용하여 지방세포(adipocyte)에서 세포사멸에 관여하는 protein kinase B의 인산화 정도를 확인하였다. 또한 면역조직화학염색법(immunohistochemistry, IHC)을 수행하여 지방조직에서 전체 대식세포의 수가 어떻게 변화하는지 확인하기도 하였고, mRNA 수준에서 M2ф로의 표현형 변화에 영향을 미칠 수 있음을 시사하였다[27]. 또한 국내 연구진은 비만쥐를 대상으로 운동이 대식세포 침윤 관련 유전자 발현을 저해시킬 수 있다고 보고하기도 하였다[30].
이와 같이 장기간의 운동과 일회성의 운동 모두 M1ф/Mф의 비율을 변화시켜 비만을 개선시킬 수 있는 가능성이 여러 연구에서 확인되었다. 그럼에도 불구하고 여러 연구자들은 M1ф/M2ф의 실질적인 분극 변화를 합리적인 방법으로 확인하지 않아 지방조직에서 대식세포 분화 관련 유전자들의 발현 차이가 실제로 M1ф/M2ф 분극에 변화를 가져왔는지는 여전히 확인된 바가 없다. 또한 Oliveira와 그의 동료 연구자들은 일련의 운동 및 면역관련 연구에서 연구 부정을 저질러 논문 게재가 철회되기도 하여 연구결과의 진실성이 의심되기도 한다[26,31].
따라서 일회성 운동과 장기간의 운동 모두 M1ф/M2ф의 변화를 가져올 수 있다는 기존의 연구결과를 재검증하고 운동에 의한 지방조직에서의 실질적인 M1ф/M2ф 분극 변화를 확인하고자 하기 위한 추가적인 연구가 필요하다. 또한 합리적인 M1ф/M2ф 비율을 산정하기 위해서는 TNF-α, MCP-1 그리고 TLR4와 같이 지방세포와 대식세포에서 모두 발현되는 면역학적 매개변수(parameter)를 제외하여야 한다. 이를 위해서는 지방조직에서 지방세포를 분리하고 대식세포에서만 발현되는 F4/80을 인지하여 살아있는 세포에서 측정되어야 한다. 이전의 연구들은 이전의 장기간 운동관련 연구에서도 이러한 연구의 제한점을 정확하게 인지하고 있었다[22]. 따라서 우리는 형광표지세포분류기(fluorescence-activated cell sorter, FACS)를 이용하는 것이 합리적이라고 판단하였다. 유세포분석기(flow cytometry) FACS는 각각의 다른 항체로 형광표지된 세포를 분석하여 두 종류 이상의 세포군의 정확한 선별이 가능하며 컴퓨터로 해석된 정보로 바로 그 세포의 유형의 분석이 가능한 방법으로 면역학에서 폭넓게 사용된다. 국내의 운동과 면역 관련 연구에서도 활용되는 방법이기도 하다[32,33].
궁극적으로 일회성 운동과 장기간의 운동에 대한 효과를 모두 검증해야 하지만 본 연구자는 장기간의 운동을 통한 변화를 확인하기 이전에 급성면역반응과 대식세포의 변화를 확인하는 것이 우선적이라고 생각하였다. 그리고 비만과 인슐린 내성과 관련된 전 염증 상태와 관련하여 비만에서의 지방은 WAT로 축적되는 것이 알려져 있고, WAT에서의 대식세포의 침윤(infiltration)이 비만 관련 인슐린 저항성 발달에 필수적인 것으로 알려져 있다[34-36]. 따라서 운동과 비만 개선에 관련한 대식세포의 변화가 가장 의미 있는 부위는 대표적인 WAT로 알려진 부고환(epdidymal) 지방조직이다[34-36]. 또한 앞서 언급한 이전의 운동과 지방조직의 대식세포 변화 관련 연구에서도 부고환 지방조직을 이용하였기 때문에 이전 연구와의 수평적 비교 검증을 위하여 부고환 지방조직을 선정하였다.
따라서 본 연구자는 세포를 특성에 따라 분류하기 위하여 FACS를 사용하였으며, 일회성 운동을 실시한 후 부고환 지방조직에서 지방세포를 분리하여 그 중 살아있는 전체의 대식세포를 동정하고 M1ф와 M2ф를 각각 형광표지하여 M1ф/M2ф의 표현형 차이에 따라 분류하여 대식세포의 분극이 실제로 어떻게 변화하는지 확인하고자 하였다.
연구 방법
1. 연구 설계
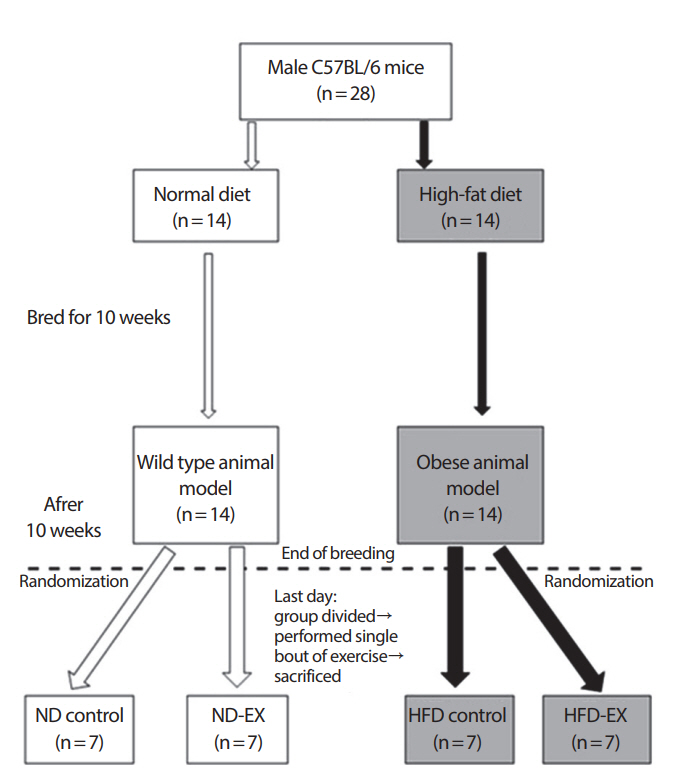
6주령의 수컷 C57Bl/6 종 마우스 28마리를 분양받아 10주간 사육되었다. 실험기간 동안 실험동물 중 14마리는 일반식이를 섭취하였으며 나머지 14마리는 고지방식이를 섭취하여 비만이 유도되었다. 10주간의 사육이 끝난 후 일반식이를 섭취한 실험동물 중 7마리와 고지방식이를 섭취한 실험동물 중 7마리를 각각 무작위 선별하여 실험 종료일에 일회성 운동을 실시하였다. 따라서 최종 집단 구성은 일반식이군(normal diet control, ND control; n=7), 운동군(ND exercise, ND-EX; n=7), 고지방식이군(high-fat diet control, HFD control; n=7) 그리고 고지방운동군(HFD exercise, HFD-EX; n=7)으로 이루어졌다(Fig. 1). 실험동물은 자동 항온 및 항습 그리고 12시간 자동 명암주기 시스템이 설치된 동물실험실에서 사육되었다. 또한 식이와 음수는 자유식이(ad libitum)로 공급되었다. 본 연구는 부산대학교 동물실험윤리위원회의 승인(PNU-2017-1669)을 받아 실시되었다.
2. 운동 방법 및 체중 및 식이섭취량 측정
모든 일회성 운동 집단은 동물용 트레드밀(DJ-344; Daejong Instrument Industry, Daejeon, Korea)에서 운동을 수행하였다. 마우스의 운동 강도는 명확한 기준이 있지는 않으나 대체로 12-20 m/min의 속도로 30분에서 1시간가량 수행된다. 특히 실험에 사용된 C57BL/6 마우스는 젖산 역치를 통한 임계속도 추정 연구에서 약 18.7 m/min의 임계속도를 가지는 것으로 알려졌다[37]. 따라서 그 이상의 속도는 마우스에게 극도의 스트레스가 주어져 오히려 운동자체의 효과보다는 중재요소가 아닌 스트레스가 대식세포의 변화에 더 큰 영향을 미칠 수도 있을 것으로 예상되었다. 운동강도 설정을 위해 최종 실험 2주 전 하한 속도 12 m/min과 상한 속도를 18.7 m/min으로 정하여 예비실험을 통하여 15 m/min의 속도는 정상 마우스와 비만 마우스 모두 트레드밀에서 뒤처지지 않으면서도 1시간가량 운동을 수행할 수 있는 최적의 속도임을 확인하였다. 따라서 일회성의 운동은 트레드밀 작동 후 5분간 5 m/min의 속도로 웜-업을 실시하고 이후 60분 동안 15 m/min의 속도로 운동을 수행되었다. 운동 수행이 끝난 후 5분 동안 5 m/min의 쿨-다운을 실시하였다. 운동을 하지 않은 집단들도 운동집단의 운동시작에 맞추어 식이공급을 중단하고 일회성 운동 실시 중에 트레드밀과 같은 공간에 배치하여 트레드밀의 소음과 진동을 느끼도록 하였다. 체중과 식이섭취량은 실험기간 동안 매주 1회 측정되었다.
3. 분석 방법
1) 조직 채취
연구목적에 따라 일회성 운동에 대한 운동과 식이의 영향을 모두 포함하기 위하여 10시간 이상의 장시간 절식은 실시하지 않았다. 장시간의 절식 또한 대식세포의 변화에 영향을 미친다고 알려져 있으며, 음식 섭취 후 인슐린의 작용에 의해 대식세포 관련 유전자 발현이 영향을 받을 수 있다[34]. 따라서 절식은 최소화하되 최종 식이 섭취 후 혈당과 인슐린의 수치가 기저치로 돌아올 수 있도록 단시간의 절식을 실시하였다. 이에 따라 ND control과 HFD control은 일회성의 운동을 수행하는 동안 절식을 수행하였고, 최종 운동 후 식이섭취는 인슐린의 분비를 증가시키고 대식세포의 변화에 영향을 미치므로 ND-EX와 HFD-EX는 식이를 공급하지 않고 음수만 정상적으로 공급하였다. 또한 운동이 대식세포에 미치는 반응은 급속도로 변화하지만 운동에 의한 급성적인 저산소증(hypoxia) 또한 대식세포 변화에 큰 영향을 미치므로 최소한의 호흡관련 인자들이 정상상태로 돌아올 때까지 2시간동안 휴식을 취하였다[38]. 음수는 정상적으로 공급되었다. 모든 실험동물은 이산화탄소로 희생시키고 복부를 절개하여 대표적인 WAT인 부고환 지방조직을 채취하였다. 채취한 지방조직은 0.9% 생리식염수로 세척하여 FACS 분석에 즉시 이용되었다.
2) 경구당부하 검사(oral glucose tolerance test, OGTT)
체중변화뿐만 아니라 비만으로 인한 대사적 이상이 발생하였는지 확인하기 위하여 OGTT를 실시하였다. OGTT는 실험종료 2주일 전에 실시하여 OGTT에 실시되는 절식과 꼬리정맥의 미세한 상처에 대한 영향을 피하고자 하였다. 17시간의 절식 후에 OGTT가 실시되었다. 절식 시작 전 깨끗한 케이지로 실험동물을 옮긴 후 식이공급을 중단하여 깔집이나 사료 부스러기 등에 의한 공복 혈당의 개입요소들을 완벽히 차단하였다. 음수는 정상적으로 공급하였다. 꼬리정맥을 면도날로 약하게 베어내 혈액을 채취하고 공복 시 혈당을 측정하였다. 이후 20%의 포도당 수용액을 곡선 위관(curved gavage needle) 삽입을 통하여 경구투여하였으며, 투여량은 17시간 절식 후 측정된 공복시 체중에 근거하여 설정되었다 (공복시 체중 [g]×10 =20% 포도당 수용액 투여량[μL]). 포도당 수용액의 경구투여 후 꼬리정맥을 가볍게 압박하여 맺힌 혈액을 각 15분, 30분, 1시간 그리고 2시간 후 측정지에 점적하여 측정되었다. 모든 혈액은 ACCU-CHEKⓇ active (Roche Diabetes Care GmbH, Mannheim, Germany) 혈당측정기를 이용하여 측정되었다. OGTT 중 포도당 제거율을 평가하기 위하여 시간 경과에 따른 혈당치를 측정하여 꺾은선 그래프로 나타내어 곡선하면적(area under the curve, AUC)을 삼각함수법(trigonometric function)으로 계산하였다[39]. 전체적인 추세를 결정하기 위하여 총 AUC를 계산하고 비교하였다. 처음 30분(T0-T30)을 비교하여 초기 인슐린 반응의 차이를 추정했다. 또한 나머지 시간(T30-T120)의 AUC를 비교하여 혈당 제거율이 인슐린의 작용 후 혈당제거 능력을 평가하였다.
3) FACS
지방조직의 살아있는 세포에서 M1ф/M2ф의 분극을 확인하기 위해 희생 즉시 지방조직을 적출하여 수행되었다. 실험동물의 지방조직을 생리식염수로 세척한 뒤 잘게 자르고 2%의 소혈청알부민(bovine serum albumin, BSA)과 클로스트리듐속(Clostridium histolyticum)에서 추출되어 만들어진 0.5 g/L의 type 1 collagenase (Sigma-Aldrich, St. Louis, MO, USA)가 첨가된 HEPES (4- (2-hydroxyethyl)-1-piperazineethanesulfonic acid) buffer (pH7.4)에 넣고 37°C에서 1시간 소화시켰다. 소화된 지방조직은 100 μm의 거름망에 걸러 원심분리용 튜브(conical tube)에 받아낸 후 1,200 rpm으로 5분간 원심분리 하였다. 지방조직에서 분리된 지방세포는 혈구계산판(hemocytometer)을 이용하여 세포 수를 계산하였다. 세포의 생존율은 90% 내외였다. 세포 수를 계산한 후, 다시 1,200 rpm에서 5분간 원심분리하고 2×106 cells/mL가 되도록 FACS buffer (2 mM EDTA, 0.5% BSA)로 재부유(resuspend)시켰다. 이후 빛을 차단한 4°C 냉장고에서 혼합기(shaker)로 30분 동안 저지항체(blocking antibody, 20 μg/mL)를 넣고 잘 섞이도록 하였다. 다시 형광복합항체(fluorophore-conjugated antibody)와 동형대조항체(isotype control antibody)를 넣고 50분간 반응시켰다. 지방세포는 anti-F4/80-FITC, anti-CD11c-PE 그리고 anti-CD206-APC (eBioscience, San Diego, CA, USA) 항체로 형광표지되었다. 형광표지 후 FACS (FACS CantoTM II, BD Biosciences, San Jose, CA, USA)에서 모든 지방세포에서 살아있는 대식세포가 분류되었고 형광표지에 따라 대식세포의 유형이 분류되었다. F4/80 항체는 모든 대식세포를 표지하고 CD11c 항체와 함께 이중표지 된 세포는 M1ф 그리고 CD206 항체와 함께 이중표지된 세포는 M2ф로 분류되었다. 결과는 FlowJo software version 10 (Treestar, Ashland.OR, USA)으로 분석되었다 .
4) qPCR
TissueLyser LT (Qiagen, Hilden, Germany) 균질기를 이용하여 1.5 mL의 분쇄용 튜브에 지방조직과 함께 50-mm의 쇠구슬과 TRIzol (Life Technologies, Carlsbad, CA, USA) 시약을 넣고 50 Hz에 5분간 분쇄하여 균질화시킨 후 RNA를 추출하였다. cDNA는 M-MMLV RT (Promega, Madison, WI, USA) 반응 시약으로 합성되었다. 합성된 cDNA로 대식세포 분화와 관련된 유전자 발현을 분석하기 위하여 선정된 유도형 NO 생성효소(inducible nitric oxide synthase, iNOS), 종양괴사 인자-α (tumor necrosis factor alpha, TNF-α), 인터루킨-6 (interleukin-6, IL-6), 세포간부착분자(intercellular adhesion molecule, ICAM-1) 그리고 알기나제-1 (arginase-1, Arg1)을 분석하였다. 96 well-plate에 cDNA와 각 유전자별 프라이머 그리고 AMPIGENEⓇ qPCR Green Mix Lo-Rox (Enzo Life Science, Farmingdale, NY, USA)가 혼합된 샘플을 삼중(triplicated) 분주하였다. 샘플들 사이의 mRNA 수준을 표준화하기 위하여 glyceraldehyde 3-phaphate dehydrogenase (GAPDH)가 항존 유전자로서 함께 증폭되었다. LightCyclerⓇ 96 real-time PCR system (Roche Diagnostics, Basel, Switzerland)을 사용하여 증폭 및 분석되었다. 실험에 사용된 각 유전자별 프라이머 서열은 Table 1에 나타내었다. 실험 후 측정된 cycle threshold (Ct) 값을 2-ΔΔC(T)법에 의해서 결정하여 분석하였다[40].
4. 자료처리방법
통계분석은 SPSS software version 23 (SPSS, Inc., Chicago, IL, USA)을 이용하여 수행되었다. FACS 결과는 집단 내 차이를 알기 위하여 독립표본 t-검증(independent-samples t-test)을 수행하였고, 그룹 간 비교를 위해 일원변량분석(one-way ANOVA)을 이용하였다. 체중변화와 OGTT 결과는 이원반복분산분석(two-way repeated measures ANOVA)에 의해 분석되었고 사후검증은 Bonferroni의 방법을 사용하였다. qPCR 결과는 2-ΔΔC(T)법에 의하여 결정된 ND control 그룹의 ΔΔCt값 1을 기준으로 나머지 그룹과의 독립표본 t-검증을 수행하였다. ND control 그룹을 제외한 나머지 그룹 간의 차이는 일원변량분석을 수행하여 분석되었다. 모든 통계적 유의수준은 p<.05로 설정하였다.
연구 결과
1. 체중증가, 식이섭취 그리고 식이효율
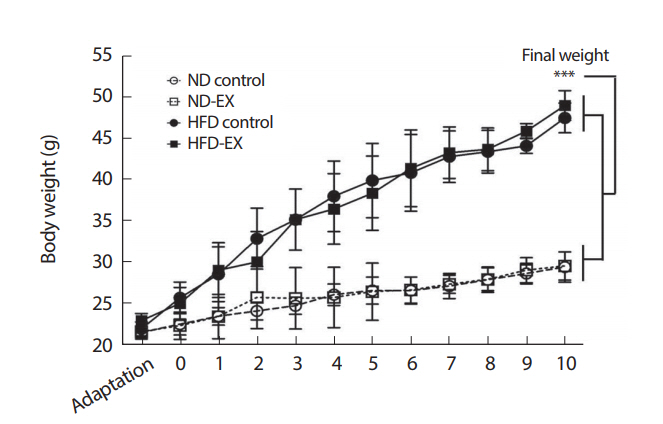
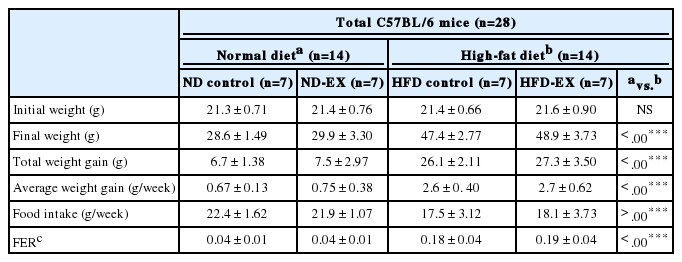
10주간의 고지방식이 섭취를 통해 일반식이를 섭취한 집단과 고지방식이를 섭취한 집단 사이의 신체적 특성과 식이경향을 비교하였다(Table 2, Fig. 2). 그룹 간에 초기 체중에서는 유의한 차이가 없었고 최종 체중과 총 체중증가 평균체중증가 그리고 식이섭취와 식이효율에서 모두 고지방식이를 섭취한 집단에서 유의하게 높게 나타났다[p<.001, ND-fed {normal diet-fed animals (n=14)} vs. HFD-fed {high-fat diet-fed animals (n=14)}]. 본 연구의 특성상 동물사육 마지막까지 그룹분류를 하지 않았기 때문에 체중증가와 식이섭취 그리고 식이효율에 미치는 영향을 통계적으로 비교하는 자체가 무의미하므로 최종 실험그룹 간 통계분석은 실시하지 않고 각 그룹의 개체별 특성만을 나타내었다(Table 2). 또한 체중변화량에 있어서도 고지방식이를 한 집단에서 꾸준히 체중이 증가하여 최종체중에서 유의한 차이가 나타났다(p<.001, ND-fed vs. HFD-fed).
Information on weight change, food intake, and efficiency in the different groups during obesity induction phase
2. 혈당 측정 결과
모든 개체의 혈당 측정 시간별 결과치를 평균 비교하고 그래프로 나타내고 경향을 나타내었다(Fig. 3A). 고지방식이를 섭취하여 비만이 유도된 실험동물은 일반식이를 섭취한 집단에 비해 전체적으로 AUC가 넓은 경향을 보였다. 또한 포도당의 경구투여 후 15분 후에 유의하게 고지방식이를 섭취한 집단에서 혈당이 높게 나타났다. 30분 후에 혈당치에서는 유의한 차이가 없었고, 이후 60분과 120분에서 고지방식이 집단에서 혈당치가 유의하게 높게 나타났다 (p<.001, ND-fed vs. HFDfed). AUC를 계산하여 전체면적(Fig. 3B)과 공복시 혈당과 경구투여 후 30분 이후(T0-T30)까지의 혈당 측정치(Fig. 3C) 그리고 1시간 이후부터 2시간 이후(T60-T120)의 혈당 측정치(Fig. 3D)의 AUC를 각각 계산하여 분석하였다. 전체 AUC의 경우에서는 고지방식이를 섭취한 집단에서 유의하게 AUC가 넓게 나타났다(p<.001, ND-fed vs. HFD-fed). T0-T30 AUC의 경우도 마찬가지로 고지방식이 집단에서 유의하게 높았으며(p <.05, ND-fed vs. HFD-fed), T60-T120구간에서도 마찬가지였다(p<.001, ND-fed vs. HFD-fed).

Changes in control ability of blood glucose concentration after obesity induction phase. Data are presented mean±SD. (A) Time-dependent changes in blood glucose during OGTT. (B) Calculated AUC by blood glucose concentration during the entire OGTT. (C) Calculated AUC by blood glucose concentration up to 30 minutes after start OGTT. (C, D) Calculated AUC by blood glucose concentration between 60 and 120 minutes after start OGTT *p <.05, ***p <.001, ND-fed animals (n=14) vs. HFD-fed animals (n=14).
3. 대식세포의 M1ф/M2ф 분극(polarization) 확인
모든 M1ф와 M2ф 각각의 특이적 표지자인 CD11c와 CD206이 지방조직에서 추출된 모든 대식세포의 표지자인 F4/80으로 표지된 세포에 이중표지 되었고, FlowJo software로 분석된 분류결과 사진을 나타내었다(Fig. 4A). 또한 모든 결과를 취합한 통계분석 결과를 나타내었다. Fig. 4B에서는 FACS에서 F4/80으로 표지된 세포를 게이팅(gating)하고 확실한 M1ф와 M2ф를 확실히 분극된 세포만을 지정하여 비율을 도출하고 그 값을 통계분석하였다. Fig. 4C에서는 M1ф와 M2ф의 합을 전체 대식세포라고 가정하고 100%로 환산한 다음 각각이 차지하는 비율을 그래프로 나타내었다. Fig. 4B에서 대식세포의 분극은 ND control을 제외한 모든 그룹에서 유의미한 변화가 나타났다. ND-EX는 M2ф가 유의하게 높은 것으로 나타났고(p<.01, M1ф vs. M2ф), 고지방식이를 섭취한 HFD control과 HFD-EX는 반대로 M1ф로의 분극이 크게 나타나는 것으로 나타났다(p <.01, M1ф vs. M2ф in HFD control; p<.001, M1ф vs. M2ф in HFD-EX). Fig. 4C의 전체 비율에서는 M1ф/M2ф의 비율 차이가 유의미한 그룹은 HFD-EX가 유일했으며, M1ф의 비율이 높았다(p<.05, M1ф vs. M2ф in HFD-EX). 각 그룹 간의 비교분석은 M2ф의 분극이 얼마나 높았는지 확인하기 위하여 M2ф에서 M1ф의 분극은 뺀 값으로 수행되었다(Fig. 4D). 그 결과 ND control에 비하여 HFD-EX가 유의하게 M2ф로의 분극이 낮았고(p<.05, ND control vs. HFD-EX), M2ф의 분극이 가장 컸던 ND-EX에 비해 HFD control과 HFD-EX도 유의하게 발현이 낮게 나타났다(p <.01, ND-EX vs. HFD control; p<.001, ND-EX vs. HFD-EX).

Changes in M1ф and M2ф subpopulations with single bout of exercise and obesity. Data are presented mean±SD of seven mice per group. Representative FACS plots F4/80+cells gated on macrophages. (A) After single bout of exercise and CD11c+ and CD206+subpopulations gated on F4/80+cells. (B, C) Difference in M1ф/M2ф ratio evaluated by statistical analysis. (D) M2ф polarization evaluation with M2ф-M1ф (**p <.01, ***p <.001, different between groups or factors indicated by connecting lines; § p <.05, different in M1ф/M2ф ratio within HFD-EX).
4. 지방조직에서의 대식세포 관련 유전자 발현 분석
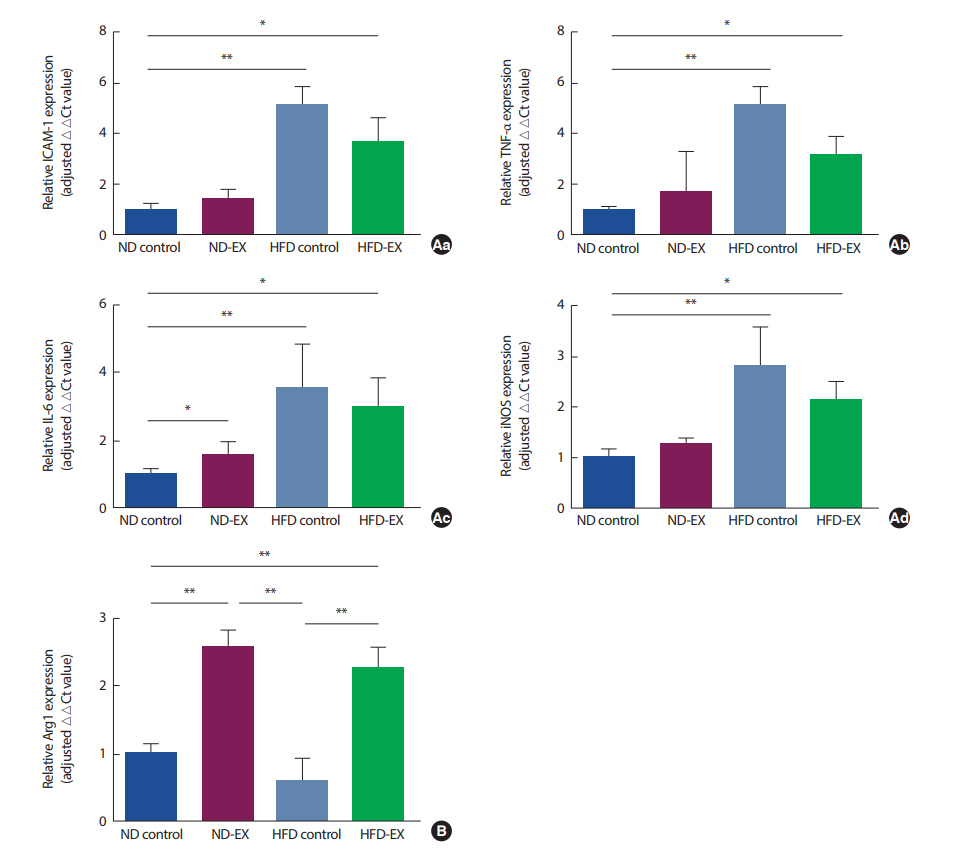
염증세포의 부착과 이동에 관여하는 염증성 단백질인 ICAM-1의 발현은 TNF-α와 같은 염증성 사이토카인(pro-inflammatory cytokine)의 활성화를 자극하고 T 세포의 활성화에 관여한다. 따라서 ICAM-1의 발현에 의해 염증성 사이토카인인 TNF-α와 IL-6가 자극된다. 따라서 우리는 ICAM-1과 TNF-α 그리고 IL-6를 분석하였고, 체내 증식된 대식세포에 의해 과발현되는 iNOS를 측정하여 M1ф의 관련 유전자 발현이 어떻게 변화하는지 확인하였다(Fig. 5A). 또한 이러한 발현의 변화가 M2ф의 관련유전자와의 길항작용(antagonism)에 의해 일어나는지 확인하고자 M2ф 특이적 유전자인 Arg1의 발현을 분석하였다(Fig. 5B). M1ф 관련 유전자의 발현 경향은 고지방식이를 섭취한 HFD control과 HFDEX에서 발현이 유의하게 높은 것을 확인하였다(Fig. 5A-a, b, c, and d). ICAM-1, TNF-α 그리고 iNOS의 경우 HFD control과 HFD-EX에서 ND control과 비교하여 유의하게 발현이 높았다(p<.05, ND control vs. NDEX; p<.01, ND control vs. HFD control). IL-6의 경우에는 ND-EX에서도 ND control과 비교하여 유의한 차이가 있었다(p <.05, ND control vs. ND-EX). Arg1의 경우 ND control과 비교하여 운동을 실시한 ND-EX와 HFD-EX에서 유의하게 높은 경향을 볼 수 있었다(p <.01, ND-EX vs. HFD-EX). 또한 일원배치분산분석 결과에서도 통계적으로 유의한 차가 ND-EX와 HFD control 사이와 HFD control과 HFD-EX사이에 나타났으며(p<.01, ND-EX vs. HFD control and HFD control vs. HFD-EX), 운동을 실시한 ND-EX와 HFD-EX에서 발현이 높았다.
논 의
비만유도 기간 동안의 고지방식이 섭취는 높은 식이효율에 의해 과도한 체중의 증가를 초래하였다(Fig. 2). OGTT 결과에서 확인할 수 있듯 total AUC와 초기의 인슐린 반응, 즉 인슐린 감수성과 관련이 깊은 T0-T30 구간의 AUC가 고지방식이를 섭취한 집단에서 높게 나타났고, 인슐린 작용 후 실제적인 포도당 제거효율을 나타낸 T60-T120 구간에서도 AUC가 유의하게 높게 나타났다(Fig. 3). 이는 본 실험과 동일한 수컷 C57BL/6 마우스와 60%의 고지방식이 섭취로 수행된 비만 유도 실험에서 17일간의 유도만으로도 인슐린 저항성이 유발되었으며 동일한 마우스 및 동일한 식이조성으로 수행된 다른 연구에서도 8주간의 고지방식이 섭취를 통해 극도의 인슐린 저항성이 유발되었음을 확인하였다[41,42]. 이러한 사실은 본 연구에서의 10주간의 고지방섭취는 비만이 효과적으로 유도되기에 충분한 기간임을 의미한다. 또한 10주간의 고지방식이 섭취를 통해 대사적 이상을 동반하여 본 연구의 실험대상 동물들이 체중 증가뿐만 아니라 대사적으로도 합병증을 가진 임상적인 비만 상태가 되었음을 의미한다. Oliveira의 일회성 운동과 비만쥐에서의 대식세포 변화 관련 연구에서는 비만 유도 후에 인슐린 저항성은 측정되지 않았고, 일회성 운동 후 4시간 뒤에 측정되었다. 이러한 사실을 많은 문제점을 안고 있다[27]. 가장 큰 문제점은 인슐린 저항성의 측정 직후에 대식세포의 분화를 측정했다는 사실이다. 해당 연구에서 인슐린 저항성을 측정하기 위한 실험법으로 hyperglycemic-euglycemic clamp를 실시하였는데 해당 실험법은 정맥과 동맥에 각각 삽관을 해야하기 때문에 비침습적이지 않아 면역세포의 변화에 영향을 미칠 수 있다[43]. 또한 실험 수행 동안 120분간의 지속적인 포도당과 인슐린의 투여는 실제 인슐린 신호전달과 관련된 대식세포 관련 유전자의 발현을 증가시킬 수 있다. 또한 동물에게는 장시간의 실험 수행 자체가 상당한 스트레스가 될 수 있다. 따라서 대식세포의 분극을 측정하기 위한 연구에서는 중재 후에 개입을 최소화하는 것이 중요하다고 할 수 있다. 본 연구에서는 이러한 대식세포에 영향을 미칠 수 있는 인자들을 최소화하고 이미 일회성의 운동 후에도 인슐린 민감성을 향상시킬 수 있다는 것은 이미 잘 알려져 있기 때문에 비만 유도 후 운동중재 이전에 인슐린 저항성을 측정하는 것이 더욱 의미가 있다고 판단하였다[24,25,44]. 또한 연구의 목적인 정확한 대식세포의 분극 측정을 위해서는 실험 동물의 희생 직전에 인슐린 저항성을 측정하는 것이 오히려 실험의 결과를 자칫 오해하게 될 수 있는 중대한 오류가 될 수 있다고 판단하였다. 따라서 일회성의 운동수행 이후에는 지방조직 내 지방세포 추출 직전까지 대식세포에 영향을 미칠 수 있는 배제하고자 실험 종료 2주 전에 미리 인슐린 저항성 측정을 위해 OGTT를 수행하였고 희생 직전에는 체중을 측정하여 비만을 판단하였다.
실험동물의 지방조직을 등장액인 HEPES buffer를 이용하여 살아있는 상태의 지방세포를 추출하였고 FACS를 이용하여 지방세포들 중 대식세포와 그 유형을 분류하였다(Fig. 4A). 본 연구자는 Fig. 4B의 cell population에서 M1ф과 M2ф의 합이 ND control에서 다른 그룹들에 비하여 현저하게 낮은 것을 확인할 수 있었다. 이러한 결과는 여러 연구에서 확인되었듯 운동은 선천면역세포의 수를 증가시키고 대식세포의 기능을 자극할 수 있으며, 비만도 마찬가지로 염증의 증가에 의해 대식세포의 증가를 시킬 수 있기 때문으로 생각된다[35,45-47]. 그러나 운동과 비만에 의한 대식세포의 반응에는 분명한 차이가 있으며, 대식세포의 운동과 고지방식이에 의한 자극은 대식세포의 유형이 각각 다르게 분극된다는 것을 확인하였다(Fig. 4B). 특히, ND-EX에서의 현저하게 높은 M2ф의 분극은 일회성 운동만으로도 염증을 자극하여 전체 대식세포를 크게 증가시키만, 오히려 항염증작용에 관련하는 M2ф의 분극 비율이 높았다. 반대로 HFD control에서는 M1ф의 분극이 유의하게 높았다. 일회성 운동과 지방조직에서의 대식세포 분극에 관련한 Oliveira와 그의 동료들의 연구에서는 정상쥐에 운동을 실시한 그룹이 없이 IHC를 실시하여 대조군과 HFD control 및 HFD-EX를 비교하여 대식세포의 침윤을 평가하였다. 그래프의 통계표시와 그림 설명문(figure legend)이 일치하지 않아 무엇을 의미하는지 혼란을 주기는 하나, 설명에 따르면 아마도 해당 논문의 #표기가 HFD와 비교한 p <.01 수준에서 유의차를 의미하는 것으로 보이며 이는 전체 F4/80+ 대식세포가 HFD에 비해 HFD-EX에서 감소하며, 대식세포의 표면에 존재하는 macrophage galactose-type C-type lectin (MGL-1)이 증가한 것으로 나타났다[27]. 그러나 F4/80과 MGL-1 모두 대식세포의 표지자로서 이러한 연구결과는 상호 모순적이다. 따라서 전체 대식세포의 변화와 대식세포 분극의 변화 모두 확인하지 못하였다는 것이 결론이며 결국 대식세포의 분극은 확인하지 못하였다.
본 연구에서 사용된 FACS 결과로 M1ф/M2ф의 분극 비율 변화가 논의되는 것은 IHC나 qPCR 같은 실험법에 비해 직접적이고 정량적이며, 살아있는 세포를 이용하였기 때문에 신뢰도와 타당도가 훨씬 높다고 할 수 있다. 그러므로 정상 마우스에서 일회성 운동에 의해 증가하는 M2ф의 실제적인 변화는 확실히 증명되었다고 보아도 무방하다. 이러한 사실은 일회성 운동은 급성적으로 염증반응을 높이지만 장기간의 운동과 마찬가지로 항염증작용을 하는 사이토카인이나 이동성 단백질들의 발현을 정상적으로 조절함으로써 면역체계의 균형을 유지한다는 것을 말해준다. 또한 이전 연구결과들과 마찬가지로 비만은 M1ф를 증가시키고 이로 인한 비정상적인 면역반응으로 전신의 염증반응이 유발되고 있음을 시사하고 있다[48]. 그러나 기대와는 달리 고지방식이에 의해 유발된 비만동물에서 일회성의 운동의 실시는 오히려 급격한 M1ф의 증가를 초래하였다(Fig. 4B, C, and D). 이러한 사실은 HFD-EX 내에서 M1ф과 M2ф의 비율은 F4/80+ 세포 중에서도 유의한 차이가 있었고(Fig. 4B), M1ф/M2ф를 합하여 전체 대식세포로 감안하여 비율을 산정한 값에서도 유의한 차이가 있었다는 결과에서 확인할 수 있었다(Fig. 4C). 그룹 간의 비교분석에서도 HFD-EX가 ND control (p <.05)과 ND-EX (p <.001)와 차이가 있었다. 특히 ND-EX와의 차이는 두 그룹 간의 차이는 “고지방식이로 인한 비만”이라는 단일 인자가 M1ф에서 M2ф로의 표현형 전환을 억제하였다는 것을 의미하고 있다. 이전의 연구에서는 일회성의 운동이 M2ф 관련 유전자의 증가만으로 대식세포 분화를 유도할 수 있다고 하였으나 본 연구에서 실질적으로 세포의 M2ф 분극을 증가시키지 높이지 못한다는 것을 확인하였다. 따라서 이전의 일회성 운동 관련 연구는 유전자 발현 수준에서의 차이만을 가지고 추론하여 대식세포 분화를 유도할 것이라고 결론에서 언급하였으나 실제 분극은 오히려 고지방식이와 함께 운동을 실시한 HFD-EX에서 M1ф가 가장 유의하게 높았다[27]. 그러나 본 연구에서도 마찬가지로 M2ф 관련 유전자 발현은 이전의 일회성 운동 연구와 마찬가지로 실제 증가하였다. 이러한 사실은 일회성 운동만으로는 M1ф에서 M2ф의 표현형 전환을 통한 비만의 개선이 어렵다는 것을 의미함과 동시에 몇 가지 가능성을 시사한다. 그 가능성의 첫 번째로는 운동강도가 다르게 주어졌을 때의 반응은 다를 수 있다는 사실이고, 두 번째로는 장기간의 트레이닝으로는 효과적일 수 있다는 사실이다. ND-EX에서 운동은 단독적으로 M2ф의 분극을 증가시켰으므로 일회성의 운동이 독립적으로 M1ф에서 M2ф의 표현형 전환을 가져올 수 있다는 것은 명확하다. 하지만 비만동물 모델의 특성에 따른 상대적인 운동강도가 설정되지 않아 본 연구에서 실시된 15 m/min의 강도로 1시간 동안의 운동은 급성운동으로서 실험동물에게 과도한 스트레스가 주어졌을 수 있다. 따라서 더 낮은 강도의 운동이 주어졌을 때 M2ф 분극의 증가에 효과적일 가능성이 높으며, 스트레스를 제외한 운동강도가 더욱 더 중요한 인자라면 더 높은 강도로 실시하였을 때 효과적일 수도 있다. 이에 대한 추가적인 연구가 필요할 것으로 보인다. 또한 비만을 개선하기 위해서는 장기간의 노력이 필요하듯 M1ф에서 M2ф로의 표현형 변화도 비만인 경우에는 오랫동안 증가된 M1ф로의 분극이 유지되어 왔기 때문에 일회성의 운동만으로 바뀌기는 힘들 수도 있다는 것을 보여준다. 그러나 장기간의 규칙적인 운동은 비만으로 인해 각 조직이나 장기 내의 지질수용량을 초과하여 축적되어 기능의 저해를 초래하는 일명 “지질독성(lipotoxicity)” 현상에 의하여 증가된 근육 내의 과도한 지방축적을 감소시키기도 하고 인슐린 감수성을 증가시키기도 한다[49,50]. 따라서 장기간의 운동은 이러한 긍정적인 변화와 마찬가지로 M1ф/M2ф의 표현형 변화가 함께 일어날 수 있는 것으로 예상된다. 그러므로 추후 연구에서는 장기간의 트레이닝 효과를 분석할 필요성이 있다.
그러나 본 연구자는 마지막 가능성으로 제안하고 싶은 것이 있다. 유의차는 없었으나 오히려 HFD-EX에서 M1ф 비율이 더 높았고 표준편차는 더욱 적었다는 사실은 조금 역설적으로 보인다. 따라서 본 연구에서 유발된 비만 마우스의 비만으로 인해 높은 유리지방산과 증가된 인슐린 저항성으로 인한 포도당 대체적인 지방산의 이용 증가와 관련이 있지 않을까 조심스럽게 제안해본다. 인슐린 저항성의 증가로 인한 혈당 조절 장애에 의해 세포에서 포도당 이용능력은 저하되고 지방산의 산화가 일반적으로 증가한다. 이러한 지방산 산화의 증가는 대식세포의 발현 증가를 야기할 수 있고 운동을 통하여 증가된 지방산 산화가 동시에 작용함으로써 상승작용을 일으켰을 수 있다는 가능성을 제기할 수 있다. 왜냐하면 본 연구에서 ND control에 의해 증가된 TNF-α와 IL-6는 이전 연구와 같이 지방조직에서 지방의 분해를 자극하여 인슐린 저항성을 유도한 것으로 보여지며[51], 일반적으로 운동을 통한 아디포넥틴의 증가는 AMP-활성 단백질 키나아제(AMP-activated protein kinase) 신호를 자극하여 지방산의 산화를 증가시키기 때문이다[52,53]. 또한 운동에 의해서 인슐린 감수성은 증가하고 체내 포도당 저장과 이용능력을 높일 수 있기 때문에[44], 이러한 결과가 ND-EX의 결과에 비추어 부정적인 반응만은 아닐 수도 있다고 생각된다. qPCR 결과는 이러한 가능성을 뒷받침한다. M1ф 관련 유전자(Fig. 5A)의 발현에서는 ND control에 비해서 유의하게 높게 나타났으나, 동시에 M2ф 관련 유전자인 Arg1도 유의하게 높게 발현되었다는 사실이 바로 그러한 근거이다.
결과를 직접적으로 해석하자면 고지방식이가 주어졌음에도 불구하고 ND control과 HFD control에 비해 유의하게 높게 발현되었고, ND-EX와 유의한 차이가 없으므로 같은 수준으로 유지되는 것으로 나타났다. 따라서 일회성 운동에 의해 M1ф에서 M2ф의 표현형 변화가 mRNA 수준에서 독립적으로 일어나고 있으나, 오랜기간 지속된 고지방식이에 의하여 M1ф 관련 유전자(ICAM-1, TNF-α, IL-4 및 iNOS)의 발현이 동시에 높게 일어나고 이러한 유전자 발현의 개입에 의해 실질적인 대식세포의 비율 변화에 영향을 미치지 못하였다. 하지만 M2ф 관련 유전자인 Arg1의 발현이 HFD control에 비해 HFD-EX에서 크게 증가함을 보여주어 지속적인 운동이 장기간의 M2ф 관련 유전자 발현을 자극하여 실제로 대식세포의 분극 비율 차이에 영향을 미칠 수 있다는 가능성을 보여주었다. 또한 이전의 일회성 운동연구에서는 정상식이와 함께 운동을 실시한 그룹이 없어서 평가가 불가능했으나 본 연구에서 M2ф의 발현이 ND-EX에 비해 ND control과 HFD control 모두 유의하게 발현이 낮았고, HFD-EX와는 차이가 없었다는 사실은 식이와는 무관하게 운동이 단독적으로 M2ф 관련 유전자의 발현의 증가시킨다는 것을 의미한다. 이러한 결과는 일회성의 운동만으로는 유전자 발현 조절에 의해 실제적인 M1ф/M2ф분극에 의한 표현형 비율 차이를 유도하지 못하였다는 결과와 함께 이번 연구에서 새롭게 발견한 주요 결과이다.
결 론
일회성 운동은 대식세포의 실제적인 분극 차이를 가져오지 못하나 M2ф 관련 유전자의 발현을 증가시킨다. 또한 운동이 비만이나 식이에 관계없이 독립적으로 M2ф 관련 유전자 발현을 증가시킨다는 것을 본 연구에서 새롭게 확인하였다.