강황 섭취 또는 저항 운동과의 복합 처치가 성인 남성의 간 기능 효소들에 미치는 영향
Abstracts
PURPOSE
This study aimed to investigate the effect of turmeric intake alone or in combination with resistance training on liver enzymes in adult men who regularly consumed alcohol at least twice a week.
METHODS
Twelve men (age: 36.0±5.26 years, weight: 99.9±17.9 kg, and height: 184.0±6.5 cm) were randomly assigned to the turmeric intake (2-3 g/day) alone (TI, n=6) group or the TI plus resistance training (60 minutes of RT 3 times a week) (TI+RT, n=6) group for 8 weeks. Blood was collected before and after 8 weeks of treatment. The analyzed variables included glutamic oxaloacetic transaminase (GOT), glutamic pyruvic transaminase (GPT), γ-glutamyl transferase (γ-GTP), and GOT/GPT ratio.
RESULTS
There was no significant interaction effect in all variables, but the main effect was found in all variables only in TI+RT group. The Cohen's d effect size on the main effects of the TI+RT group on GOT (d=0.548), GPT (d=0.835), γ-GTP (d=0.623), and GOT/ GPT ratio (d=0.800) ranged from 0.548-0.835, respectively. However, body composition such as percent body fat (%, p>.05) and muscle mass (kg, p>.05) did not show the main effect on time points as well as the interaction effect (p>.05).
CONCLUSIONS
Although the 8-week TI treatment did not show any statistically significant change, TI treatment showed a tendency to decrease in GOT, GPT, and γ-GTP, and the GOT/GPT ratio tends to increase. Therefore, there was a synergic effect of the TI plus RT treatment or the sum of the two treatments for 8 weeks.
Keywords: Turmeric intake, GOT, GPT, γ-GTP, Alcohol consumption, Resistance training
색인어: 강황섭취, 알코올섭취, 저항훈련, GOT, GPT, r-GTP
서 론
우리 나라의 알코올 섭취 인구는 매년 크게 늘고 있으며, 이로 인한 건강문제는 사회적 위험으로 대두되고 있다. 2014 알코올 섭취와 건강에 대한 세계기구보고서[ 1]에 따르면 2010년을 기준으로, 만 15세 이상 전 세계 성인 인구 1인당 알코올 소비량은 연간 평균 6.2 L이며, 대한민국은 그 두 배에 상응하는 12.3 L로 아시아권에서는 1위, 190개국 중에서는 15위로 보고되었다. 대한민국 국민의 연간 음주 소비율은 78.5%로 과반수 이상의 높은 수준을 나타내었으며, 남성은 86.6% 여성은 70.8%로 5년간 꾸준히 높은 수치를 기록하고 있다[ 2]. 일부 연구에 따르면, 알코올은 적당히 마시면 심혈관계 건강을 향상시키고 빈혈의 위험을 감소시키며 심리적으로 긴장을 완화시키고 불안을 감소시키는 등의 긍정적인 효과가 있는 것으로 보고되고 있으나[ 3], 과도한 음주는 가정 해체, 실업 및 직장 문제, 범죄, 재정 문제 등을 야기하며[ 4], 이로 인해 막대한 사회적, 경제적 문제를 일으킨다. 또한, 우리나라 통계청 자료에 의하면 2004년 인구 10만 명당 5,048명이 알코올 관련 질환으로 사망하였으며 이후 감소하던 수치가 2016년 4,747명으로 최근 10년 이내 가장 높은 수치를 나타내고 있다[ 5]. 특히, 알코올 섭취에 따른 사망자 수와 관련하여 알코올 섭취자가 비알코올 섭취자보다 28배나 높은 수치를 보여 알코올 섭취에 대한 문제는 그 심각성 측면에서 사회적 문제로 대두되고 있다[ 6]. 일반적으로 알코올 섭취 후 체내의 알코올은 90% 이상이 간의 효소작용에 의해 처리되며, 일반적으로 알코올 섭취 후 48시간이 지나야 정상적으로 회복되기 때문에 체내에 축적될 경우 인체에 해로운 영향을 주는 알코올을 체외로 배출시키는 것이 중요하다[ 7]. 즉, 체내에 남아있는 알코올이 간의 효소작용에 의해 분해되는 과정에서 간 기능의 손상이나 장애를 일으켜 알코올성 간염, 지방간, 간경변증, 간암 등으로 진행되어 2차 질환을 유발하는 심각한 원인이 된다[ 5]. 한편, 간 내 정상 지방량은 간 중량의 4% 내외로 지방량이 10% 초과되면 간이 붓게 되고, 늘어나는 지방은 간에 축적되어 간의 생체기능을 저하시키는 원인이 된다. 무엇보다 알코올성 지방간은 만성적인 알코올 섭취에 의해서 뿐만 아니라 고용량의 일회성 섭취에 의해서도 유도될 수 있다고 알려져 있어[ 8– 11], 이를 예방하기 위한 노력이 다각적으로 이루어지고 있다. 알코올성 간질환(alcoholic liver disease, ALD)을 치료하기 위한 선택은 지난 40년 동안 변경되지 않았고 금주는 여전히 가장 중요한 치료방법으로 주로 식이요법과 corticosteroid와 같은 스테로이드가 함께 사용되고 있다[ 12– 14]. 하지만 ALD 환자의 경우, 스테로이드에 반응하지 않는 비반응자와 금기사항이 있는 환자는 다른 치료 방법을 선택해야 한다[ 15]. 이와 관련하여 규칙적인 운동은 근력, 파워 및 근지구력 등의 운동수행능력에도 긍정적 효과를 나타내지만 비알콜성 간질환을 지닌 환자들의 간 기능을 개선시키며[ 16– 20], 간 기능이 저하된 사람 역시도 빠르게 걷기, 조깅, 등산, 수영 등과 같은 유산소운동을 규칙적으로 할 경우 지방간을 예방하는데 효과가 있다고 보고된 바 있다[ 21, 22]. 또한, 알코올 섭취 후의 유산소성 운동은 많은 양의 호흡과 땀을 통하여 알코올 대사를 촉진시켜 다량의 알코올이 체외로 배출되는 효과가 있다고 보고되었다[ 23]. 하지만 아직까지 유산소성 운동이 아닌 저항 운동 즉, 규칙적인 저항 훈련(resistance training)이 알코올 분해와 관련된 간 기능 효소 작용에 미치는 효과를 살펴본 연구는 미흡한 실정이다. 또한 간 질환에 효과가 좋다고 알려진 강황(Curcuma longa L.)은 생강과에 속하는 다년생 초본식물로, 중국에서는 간 질환을 치료하기 위해 수 세기 동안 사용되어 왔다[ 24]. 특히 강황의 주요 약효 성분인 커큐민은 동물실험과 역학조사 등에서 항암작용, 항산화작용, 항염작용, 해독기능, 간 기능 개선효과, 항바이러스, 암세포 증식과 관련한 혈관 신생억제 작용, 콜레스테롤의 생합성에 관여하는 squalene synthase 억제 작용 또는 간의 콜레스테롤 저해 효과가 있다고 알려졌다[ 25– 28]. 더욱이 비알코올성 간질환을 지닌 사람들을 대상으로 한 메타 연구[ 16, 17]에서는 8주간 하루 1,000 mg 이상 커큐민 보충제를 섭취한 후 AST ( p =.026)와 ALT ( p =.014) 모두 유의하게 감소함이 보고되었다. 하지만 비알코올성 간질환을 지닌 남성을 대상으로 실시한 운동 처치 형태(유산소 vs. 저항 훈련)에 따라 간 효소에 미치는 영향은 각기 다른 것으로 보고되고 있다. Shamosoddini et al. [ 18]의 연구에서는 비알코올성 지방간 질환을 지닌 환자를 대상으로 실시한 8주간의 유산소 운동과 저항성 운동을 각각 처치하였고 운동 형태와 관계없이 AST ( p =.02)와 ALT ( p =.02) 모두 유의하게 감소한 반면 Slentz et al. [ 21]의 연구에서는 장기간의 유산소 운동에서만 간 효소뿐 아니라 내장 및 간 지방량을 감소시켰으나 저항운동은 피하지방의 감소 이외에 어떠한 것도 유의한 차이를 보이지 않았음을 보고하였다. 또한 이들 선행연구들을 살펴보면[ 19, 20], 연구 대상자 대부분이 비알코올성 간질환을 지닌 대상자들로 간 기능 관련 효소 농도가 정상치 보다 높은 사람들로 이들 효소들이 정상 범위에 있는 일반인과는 커큐민 처치 또는 운동 처치과의 복합 처치에 따른 반응이 다를 수 있으나 이에 대한 연구는 거의 전무한 실정이다. 따라서 강황 분말의 섭취 또는 강황 분말의 섭취와 저항 훈련을 병행할 때 주기적으로 음주를 하는 30-40대 성인 남성의 알코올 분해 능력 또는 간 기능과 관련된 간 기능 효소인 glutamic oxaloacetic trans-aminase (GOT 또는 AST), Glutamine-pyruvate transaminase (GPT 또는 ALT), γ-Glutmyl transpeptidase (γ-GTP)에 어떠한 영향을 미치는지 알아보고자 한다.
연구 방법
1. 연구대상
본 연구의 대상자는 주당 2-3회 알코올을 주기적으로 섭취(주당 평균 소주 2병)하는 30-40대 일반 남성을 대상으로 최근 1년 이내 간질환 질병 판정을 받지 않은 자를 모집하여 실험을 실시하였다. 또한 이들 참여자들은 과거 10년 이상 보디빌딩, 육상 및 럭비 종목들의 선수 경험을 한 자들로 실험 참여 전 6개월 이상 규칙적인 저항 훈련을 실시하지 않는 자들이었다. 이들을 대상으로 연구의 내용과 목적, 실험절차, 피험자의 인권보호, 연구에 관련된 모든 정보에 대한 내용을 충분히 설명한 후 본 연구의 취지를 이해하고 자발적으로 참여에 동의하고 서명한 성인 남성 12명을 대상자로 선정한 후 두 집단에 각각 무선 배정 하였다. 연구 대상자의 신체적 특성은 Table 1과 같다.
Table 1.
Characteristics of Participants
|
Variables |
TI+RT (n = 6) |
TI (n = 6) |
p
|
|
Age (yr) |
34.67 ± 2.5 |
37.33 ± 7.09 |
.405 |
|
Height (cm) |
183.45 ± 3.14 |
184.45 ± 9.14 |
.805 |
|
Weight (kg) |
95.25 ± 16.58 |
104.5 ± 19.41 |
.396 |
|
BMI (kg/m2) |
28.32 ± 4.42 |
30.12 ± 3.50 |
.452 |
|
Muscle mass (kg) |
66.63 ± 6.98 |
72.76 ± 10.64 |
.267 |
|
Percent fat (%) |
23.62 ± 4.55 |
24.32 ± 4.43 |
.793 |
|
Alcohol intake per week (mL)*
|
695.00 ± 117.66 |
762.83 ± 135.49 |
.376 |
2. 연구설계
강황 분말 섭취는 하루 1,000 mg 이상 커큐민 보충제를 섭취할 때 효과가 있다는 Mansour-Ghanaei et al. [ 16]의 연구와 8주간 하루 2 g을 처치하여 간기능 효소의 유의미한 감소를 보여준 Jarahzadeh&Hosain [ 29]의 연구 및 제조사(㈜아람에프엔이치, Korea)의 사용방법에 따라 강황 분말 섭취(하루 2-3 g/1회, 350 mL의 물에 섞어 섭취)와 함께 저항운동을 하는 turmeric intake+resistance training (TI+RT) 집단 6명과 저항운동은 실시하지 않고 강황 분말만 섭취하는 turmeric intake (TI) 집단 6명을 각각 무선 배정(random assignment)하였다. 두 집단 동일하게 월, 수, 금요일 오전 공복 상황에 섭취하도록 하였고 그 이외의 건강 및 운동보조제는 일체 섭취하지 않도록 하였다. 알코올 섭취는 참여자들이 평상 시 섭취하는 양과 유사한 양을 섭취하도록 하되 주 2회 화요일과 목요일로 한정하여 두 집단 함께 섭취하도록 하였다. 알코올의 섭취 시간은 회당 2시간 이내로 일정량의 안주(육회 200 g, 삼겹살 300 g)를 동일하게 섭취하도록 하였다. 각 그룹은 사전에 체성분 검사(신장, 체중, 체질량지수, 체지방률, 제 지방량), 혈액검사(GOT, GPT, γ-GTP, 혈중 알코올 농도), one-repetition maximum (1RM)을 실시하여 각 운동 항목의 1RM을 토대로, 8주간 TI+RT 집단은 주 3회 90분씩 저항 훈련( Table 2)과 강황 분말을 섭취하였고, TI 집단은 8주간 주 3회 TI+RT 집단과 동일한 양의 강황 분말만을 섭취하도록 하였다. 또한 음주 후 일정량의 안주(육회 200 g, 삼겹살 300 g)를 제공한 후 주 2회 Widmark equation [ 30]을 대입하여 알코올 섭취량을 기록하였다: 섭취량(Ml)=(C*P*R*10)/(술의 농도*0.7894*0.7)로, C (혈중 알코올 농도 최고치%)=A/(P*R*10)이며, A=섭취한 알코올의 양(음주량*술의 농도*0.7894*체내 흡수율), P=체중(kg), R=성별에 대한 계수(남자는 0.86, 여자는 0.64)이며, 체내 흡수율은 0.7로 산출하였다. 저항 운동 장비는 SCINOT (GWA1-27, Paju, Korea)사의 웨이트 트레이닝 머신과 프리웨이트를 사용하였다. 본 연구에서 설계한 저항훈련 프로그램의 구성 원칙은 건강한 성인을 위한 저항훈련의 진행모델에 대한 ASCM position stand를 토대로 작성하였다[ 31].
Table 2.
The resistance training program
|
Division |
Workout types |
Time and configuration |
Intensity |
|
Warm up |
Treadmill |
15 min |
50-60% HRmax |
|
Resistance training program |
Mon
|
Wed
|
Fri
|
|
|
|
|
Squat
Wide Squat
Lunge
Leg Press
Dead lift
Chin-Up
Lat Pull-Down
Back Extension |
Bench Press
Push-up
Incline Bench Press
Cable Cross-over
Shoulder Press
Upright Row
Front Dumbbell Raise
Lateral Dumbbell Raise |
Dip
Triceps Push-Down
Barbell Curl
Concentration curl
Abdominal Crunch
Side bend
Plank 1 min
Leg Raise |
Each exercise
3 set, 1 set/15 rep. (60 min), rest for 90 sec between each exercise |
1 RM
60-70%/every 2-week re-evaluated |
|
Cool down |
Treadmill |
15 min |
50-60% HRmax |
3. 측정 항목 및 방법
1) 혈액채취
참여자의 채혈은 8주간의 트레이닝 시작 전과 트레이닝 종료 48시간후 전완정맥(antecubital vein)에서 6 mL씩 간호사에 의하여 수집하였다. 특히, 실험 전과 종료 후의 조건을 동일하게 하기 위하여 실험 처치 전후 모두 알코올 섭취 48시간 후 그리고 12시간 이상 공복 상태에 서 각각 혈액을 수집하였다( Fig. 1). 채혈한 혈액은 혈장 검체를 얻기 위해 혈액 응고를 방지하는 EDTA가 도포되어 있는 진공채혈관(K90313, 녹십자 MS, Korea)에 6 mL를 넣고, 완전한 혼합을 위해 두 개체 모두 8-10번 천천히 흔들어 준 뒤, 3,000 rpm으로 10분간 원심분리기(HA-1000-3, 한일산업, Korea)를 이용하여 원심 분리하였다.
Fig. 1.
Fig. 1.Experimental design. Blood collection was done after at least 12 hours of fasting. TI=turmeric intake, RT=resistance training. 
2) 체성분 검사
체성분 검사는 Inbody 720 (Korea)을 이용하였으며, 채혈이 이루어지는 날에 측정하였다. 신장, 체중, 체지방률, 체질량지수(body mass index, BMI), 제지방량, 근육량을 측정하였고 8주간 처치 전후로 총 2회 측정하였다. 측정 절차는 측정 전 48시간 동안 격렬한 신체활동 및 급격한 생활습관의 변화를 초래하지 않도록 하였으며 12시간 이상 공복 상태를 유지하도록 하였다. 안정된 상태에서 가벼운 복장으로 측정하였고 피험자는 기자재에 오른 후 개인 신상기록을 입력하고 발 전극판에 서서 손 전극판을 잡고 팔을 벌린 상태에서 약 1분간 체중(jkg), 체지방률(percent body fat), 체질량지수, 제지방량(fat free mass, FFM), 근육량(lean body mass)을 측정하였다.
3) 간 기능 효소 및 혈중 알코올 농도 분석
Glutamic oxaloacetic transaminase (GOT), Glutamate pyruvate trans-aminase (GPT)와 gamma glutamyl transpeptidase (γ-GTP) 간 기능 효소와 혈중 알코올 농도 모두 효소활성측정법으로 측정하였으며, 검사장비는 Roche cobas c702와 Roche Integra 800을 이용하여 분석하였다. 각각의 참고치(reference intervals)는 0-40 IU/L, 0-45 IU/L, 0-67 IU/L 및 <10.0 mg/dL이다.
4. 자료처리방법
본 연구를 통해서 수집된 자료는 SPSS 28.0 통계 프로그램을 이용 하였으며 모든 변인들의 측정값은 평균(Mean)과 표준편차(standard deviation, SD)를 산출하여 제시하였다. 모든 측정값에 대하여 집단별 정규성 검증(normality test)을 실시하였다. 각 변인의 집단별 결과 값이 정규성을 만족하지 못할 경우, 두 집단 간 및 시기 간의 비교는 각각 Wilcoxon rank sum test와 Wilcoxon signed rank test를 실시하였다. 모든 통계적 가설 검정은 양측 검정(two-tailed test)을 실시하였다. 집단별 각 변인들의 측정값이 정규성을 만족한 경우에는 두 처치(강황 섭취 vs. 강황섭취+저항운동)의 상호작용 효과를 알아보기 위하여 two-way mixed ANOVA (이원변량혼합분석)를 사용하였으며, 사후검증으로는 집단 간의 차이는 독립 t-검정을 이용하였고 시기간의 차이는 종속 t-검정을 실시하였다. 또한 상호작용이 나타나지 않고 집단 또는 시기의 주효과만 나타날 경우, 강황섭취 또는 강황섭취와 저항훈련의 주효과의 실제적 효과 수준을 알아보기 위하여 Cohen's d 효과 크기를 검토하였다. 통계적 유의수준은 5% (α =.05)로 설정하였다.
연구 결과
GOT의 경우, 상호작용효과( p =.495) 및 집단 간( p =.903)의 유의 차는 나타나지 않았으나 시기간의 유의 차가 나타났다( p =.039). 사후검증으로, 시기간의 차이를 알아보기 위하여 종속 t-검증을 실시한 결과, TI+RT 집단에서는 33.16 IU/L에서 27.00 IU/L로 18.6% 유의하게 감소( p =.028)한 반면, TI 집단은 32.33 IU/L에서 29.00 IU/L으로 10.3% 감소하였으나 통계적인 유의 차( p =.380)는 나타나지 않았다( Fig. 2). GPT 역시 상호작용효과( p =.495)는 유의한 차이가 나타나지 않았으나 집단간( p =.018) 및 시기간의 유의 차가 나타났다( p =.016). 사후검증으로 독립 t-검증을 실시한 결과, 집단 간의 차이는 두 집단 처치 전후 모두 TI 집단이 각각 유의하게 높은 것으로 나타났다( p <.025, p <.044). 시기간의 차이는 TI+RT 집단이 30.17 IU/L에서 22.00 IU/L로 27.1% 유의하게 감소( p =.007)한 반면, TI 집단은 52.00 IU/L에서 38.50 IU/L으로 유사한 감소 폭(26.0%)을 보였으나 편차가 커 통계적인 유의 차( p =.123)는 나타나지 않았다( Fig. 2). γ-GTP는 상호작용효과( p =.980) 및 집단 간( p =.849)의 유의 차는 나타나지 않았으나 시기간의 유의 차는 나타났다( p =.014). 사후검증으로 시기간의 차이를 알아보기 위하여 종속 t-검증을 실시한 결과, TI+RT 집단에서는 36.5 IU/L에서 27.17 IU/L로 25.6% 유의하게 감소( p =.026)한 반면, TI 집단은 38.0 IU/L에서 28.5 IU/L으로 25.0% 감소하였으나 통계적인 유의 차( p =.151)는 나타나지 않았다( Fig. 2). GOT/GPT 비율은 상호작용효과( p =.755)는 나타나지 않았으나 시기간( p =.026) 및 집단 간( p =.001)의 주효과에서는 유의 차이가 나타났다( p =.026). 사후검증으로 집단 간의 차이를 알아보기 위하여 독립 t-검증을 실시한 결과, TI+RT 집단에 비해 TI 집단이 사전 ( p =.001) 및 사후 ( p =.002) 각각 유의하게 낮은 것으로 나타났으며, 시기간은 TI+RT 집단에서만 사전에 비해 8주후에 유의하게 증가하였다( p =.050).
Fig. 2.
Fig. 2.Changes in liver function enzymes before and after turmeric intake vs. turmeric intake plus resistance exercise treatment. TI=turmeric intake, TI+RT=turmeric intake+resistance training, Pre=before treatment, 8-W=after 8-week treatment. Normal range of GOT (AST) and GPT (ALT) are 0-40 IU/L. # p<.05, ## p<.01, ### p<.001, significant difference from TI+RT group. 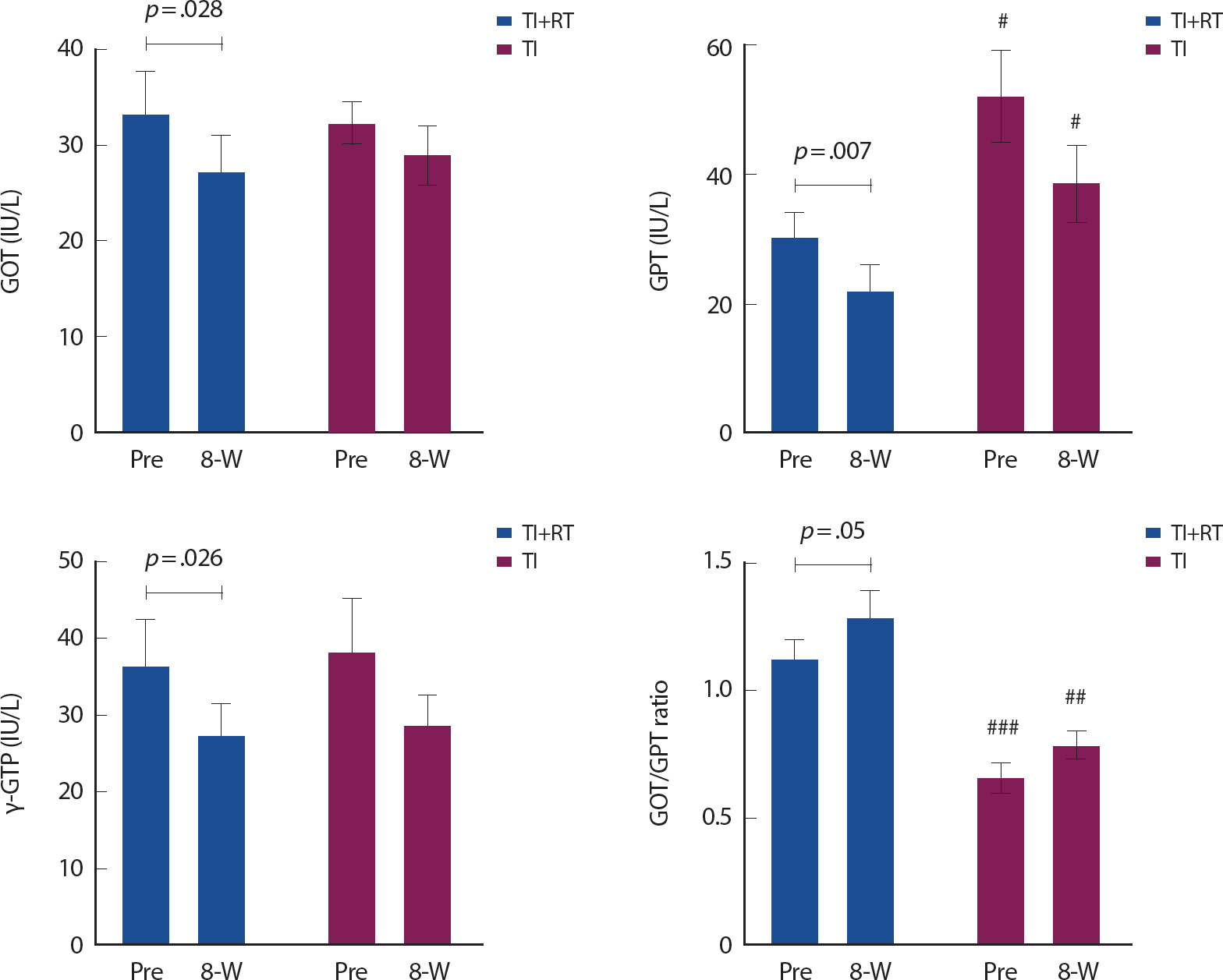
집단 간의 주효과와 관련하여, GPT와 GOT/GPT 비율에서 유의한 차이가 나타났으나 이러한 차이는 두 집단의 기초선의 차이에서 비롯되었고 그 차이가 8주에서도 유사한 경향으로 나타나 이들 결과 값에 대한 의미를 부여하기에는 한계가 있으나 시기간의 주효과와 관련하여 TI 집단과는 달리 TI+RT 집단에서만 GOT, GPT, γ-GTP 및 GOT/ GPT 비율에서 유의하게 감소 또는 증가하였다는 것은 처치의 차이에 따른 효과일 가능성이 있다. 따라서 이들 시기에 대한 실제적인 효과 크기(Cohen's d effect size)를 검토한 결과, Table 4에서처럼 중간 수준에서 높은 수준의 효과 크기(d=0.548-0.835)가 있는 것으로 나타나 강황섭취와 함께 8주간의 저항 훈련을 처치한 집단은 간 기능 효소의 활성에 긍정적 역할을 하는 것으로 나타났다( Table 3).
Table 3.
Cohen's effect size on liver enzymes before and after 8-W TI+RT treatment
|
Variables |
PRE vs. 8-week |
|
GOT |
0.548 |
|
GPT |
0.835 |
|
Υ-GTP |
0.623 |
|
GOT/GPT ratio |
0.800 |
Table 4.
Changes in body composition by group before and after treatment
|
Variables |
Group |
PRE |
8-week |
p
|
|
Weight (kg) |
TI+RT
TI |
95.25 ± 16.58
104.50 ± 19.41 |
95.56 ± 17.72
102.88 ± 19.05 |
Group = .449
Time =.317
Group*Time=.148 |
|
Percent fat (%) |
TI+RT
TI |
23.61 ± 4.55
24.31 ± 4.42 |
22.58 ± 5.25
23.85 ± 3.92 |
Group = .709
Time = .252
Group*Time = .656 |
|
BMI (kg/m2) |
TI+RT
TI |
28.31 ± 4.42
30.11 ± 3.49 |
28.40 ± 4.77
30.11 ± 3.26 |
Group = .469
Time =.832
Group*Time = .832 |
|
Muscle mass (kg) |
TI+RT
TI |
66.63 ± 6.97
72.73 ± 10.63 |
67.73 ± 6.97
71.85 ± 10.93 |
Group = .353
Time =.833
Group*Time = .076 |
한편, 8주간의 저항 훈련에도 불구하고 신체조성과 관련하여 집단별 체중, 체지방률(%), 체질량지수 및 근육량(kg)은 상호작용효과를 포함한 집단 간 및 시기간의 유의한 효과가 없는 것으로 나타났다( Table 4).
논 의
GOT (AST)와 GPT (ALT)와 같은 간 효소는 직장인들의 지방간 및 간염과 같은 간 질환 검사를 목적으로 주기적으로 검사되는 필수 항목이다. 이들 간 아미노기 전이효소(transaminases)인 혈청 GOT와 GPT 는 비 바이러스성 간 질환에서 특정 패턴을 나타내는 것으로 보고되고 있다[ 32]. 그 예로, GOT는 알코올성 간염 및 알코올성 지방간 환자에서 주로 발생하는 반면 GPT는 비만, 고지혈증, 영양과다 및 당뇨병과 관련된 간 질환으로 인한 지방간 환자에게서 주로 나타난다[ 33, 34]. 또한 γ-GTP는 개인별 편차가 크지만 알코올 섭취에 대한 민감도가 높기에 알코올 섭취에 대한 주요 마커로 알려져 있으며[ 35, 36], 아직 명확한 기전은 알려져 있지 않으나 인슐린 저항과도 밀접한 상관이 있는 것으로 알려져 있다[ 37]. 본 연구에서는 강황섭취단독 처치(TI)와 강황섭취와 함께 8주간의 저항훈련(TI+RT)이 간 질환 관련 효소인 GOT (AST), GPT (ALT), γ- GTP와 GOT/GPT 비율에 미치는 영향을 검토하고자 하였다. 본 연구결과에서는 상호작용효과는 나타나지 않았으나 강황섭취만 실시한(TI) 집단과는 달리 강황섭취+저항훈련(TI+RT) 집단에서만 유의미한 결과가 도출되었다( Fig. 2). 실제적인 효과 차이를 검토하기 위하여 Co-hen's d 효과 크기를 살펴본 결과, 강황섭취와 함께 8주간의 저항훈련을 실시한 TI+RT 집단에서만 중간에서 높은 수준(d=0.548-0.835)으로 유의한 효과 크기를 보였다. 이들 결과를 종합해 보면, 강황 섭취만(TI) 실시한 집단은 처치 전후 GOT (AST, p =.380), GPT (ALT, p =.123), γ-GTP ( p =.151)와 GOT/GPT 비율( p =.125) 모두 통계적인 유의한 차이가 나타나지 않았으나 두드러지게 감소하는 경향을 보였다. 따라서 TI+RT와 TI 집단 간의 상호작용으로 인한 처치 효과는 없었으나 강황섭취와 함께 처치한 8주간의 저항훈련(TI+RT)의 시너지 효과 또는 두 처치의 합산 효과(sum of effect)는 존재하는 것을 알 수 있었다. 구체적으로 살펴보면, GOT의 경우 TI 집단과는 달리 TI+RT 집단에서 처치 시기간 유의한 차이가 나타났다. 이러한 결과는 동물을 대상으로 알코올 섭취와 함께 8주간 지속적인 유산소운동의 처치 유무에 따른 GOT의 변화를 검토한 연구결과[ 7] 그리고 알코올성 지방간 환자를 대상으로 장기간의 운동을 처치한 후 간 기능 관련 효소의 변화를 관찰한 연구[ 38]와 유사한 것이었다. 비록 본 연구에서는 선행연구들과 달리 무처치 통제 집단이 없어 무처치 집단이 있는 다른 연구 결과와의 직접적인 비교는 어려우나 두 가지 처치를 실시한 TI+RT 집단에서는 TI 집단과는 달리 GOT의 유의한 감소 효과가 나타나 이러한 결과들을 지지하는 것으로 판단된다. GPT는 비만, 고지혈증, 영양과다 및 당뇨병과 관련된 간 질환으로 인한 지방간 환자에게서 주로 나타나는 것으로 보고되고 있다[ 33, 34]. GOT와 마찬가지로 TI 집단과는 달리 TI+RT 집단에서 처치 시기간 유의한 차이가 나타났다. SD 계열 쥐를 이용한 동물 실험 연구[ 7]에서 GPT 수준의 변화는 알코올 섭취군에서는 알코올 섭취를 하지 않은 정상군과 알코올 섭취 및 운동병행군에 비해서 확연히 높게 나타났고, 알코올 섭취와 함께 운동을 병행한 군은 알코올 단독 섭취군에 비해서 현저히 낮은 반면, 정상군과 유의한 차이는 없었다는 결과와 유사한 것이었다. 또한 흰쥐를 대상으로 4주간 고지방 식이 섭취와 함께 강황 농축 분말을 섭취시킨 군과 고지방 식이 섭취군의 비교에서 유의한 차이가 없었다는 선행연구[ 39]와도 유사한 결과이다. 즉, TI+RT 집단과는 달리 강황섭취만 실시한 TI 집단은 감소 경향은 나타났으나 유의 한 차이는 나타나지 않았다는 점 그리고 GPT가 주로 비만, 고지혈증, 영양과다 및 당뇨병과 관련[ 33, 34]되어 있으며 특히 인슐린 저항성과도 밀접한 관련이 있다[ 37]는 점에서 본 연구의 결과를 유추할 수 있다. 일반적으로 유산소 운동은 인슐린 유사 효과를 지니며 당뇨환자의 사망률 역시 감소시키는 것으로 보고되고 있다[ 40]. 일부 연구들에서는 혈당 조절에 있어서 유산소 운동 효과보다도 저항성 운동이 효과적이라고 제안하고 있다[ 41]. 비록 인슐린의 작용이 골격근의 질량과 관련되어 있으나 인슐린 민감성은 골격근의 양적 변화와는 무관하게 저항성 운동으로 인한 골격근의 질적 변화로 인해 인슐린의 민감성이 증가할 수 있다고 보고되고 있다[ 42]. 그 예로, calmodulin 의존성 단백질 키나제 II (calmodulin-dependent protein kinase II, CaMKII)는 운동강도에 비례하여 자극되며, histone deacetylases (HDACs)와 같은 전사 인자를 인산화하여 근세포 강화 인자 2 (myocyte enhancer factor-2, MEF2)와 그 표적 유전자인 Peroxisome proliferator-activated receptor gamma coactivator 1-alpha (PGC-1 α)와 Glucose transporter type 4 (GLUT4)를 활성화하여 혈당 조절을 개선한다[ 41– 43]. 비록 본 연구에서는 8주간의 강황 섭취와 저항운동을 실시한 TI+RT 집단에서의 골격근량의 유의한 변화는 없었으나 TI 집단은 감소 경향이 나타났으나 TI+RT 집단은 증가하는 경향이 나타났고, 유의한 통계적인 변화는 없었으나 8주간의 저항운동에 의한 골격근의 자극이 미미하여 양적 변화는 나타나지 않았으나 질적 변화를 일부 유도하였을 가능성이 있고, 이를 통해 GPT가 TI+RT 집단에서만 유의하게 감소했을 가능성이 있다. γ-GTP 역시도 GPT와 마찬가지로 TI 집단과는 달리 TI+RT 집단에서 처치 시기 간 유의한 차이가 나타났다. γ-GTP는 알코올 섭취에 대한 주요 마커로 알려져 있으며[ 35, 36], 인슐린 저항과도 밀접한 상관이 있는 것으로 알려져 있다[ 37]. 또한 Moriya et al. [ 44]의 연구에서는 음주를 하지 않는 사람들 뿐 아니라 음주를 주기적으로 하는 사람들에서도 γ-GTP와 인슐린 저항 수준 간의 유의한 상관성이 있음을 보고하였다. 운동 처지와 관련된 선행연구들을 살펴보면, 숙취 후 일회성 유산소 운동과 사우나 요법 적용이 혈중 알코올 농도 및 간 기능 효소에 미치는 영향[ 45]에서 유산소 운동을 한 집단의 경우 측정 시기별 유의한 차이를 보이지 않았다는 연구 결과와는 다른 결과이지만, 장기적 운동이 알코올성 지방간 환자의 γ-GTP를 정상치에 가깝게 감소시켰다는 연구[ 46]와는 유사한 결과를 나타냈다. 이러한 차이는 앞서 언급한 연구[ 45]가 일회성 처치라는 점에서 장기간의 처치를 실시한 연구들과 차이가 나타날 수 있을 가능성이 있다고 판단된다. 또한 γ-GTP 이 알코올 섭취를 판단하는 주요 지표로 활용되고 있으나 인슐린 저항 수준과도 밀접한 관련이 있다는 점[ 44]에서 그리고 이러한 인슐린 저항성은 저항 훈련에 의해 개선될 수 있다는 점에서 TI+RT 집단에서 유의한 감소 효과가 나타날 수 있을 것으로 판단된다. GOT/GPT 비율 역시도 GOT, GPT 및 γ-GTP와 마찬가지로 TI 집단 과는 달리 TI+RT 집단에서만 처치 시기간 유의한 차이가 나타났다. GOT/GPT 비율이 증가하였다는 것은 GOT가 증가하거나 GPT가 처치 전에 비해 처치 후에 감소하였다는 것을 의미하는 것이다. 본 연구결과에서는 처치 전에 비해 GOT와 GPT 모두 감소하였기에 GOT에 비해 상대적으로 GPT가 감소하였다고 할 수 있다. 아직까지 운동처치에 따른 GOT/GPT 비율 변화를 검토한 연구가 없어 직접적인 비교가 어려우나 앞서 언급했듯이, GPT의 감소는 비만, 고지혈증, 영양 과다 및 당뇨병과 관련된 간 질환으로 인한 지방간 환자에게서 주로 나타난다는 점에서 장기간의 저항운동의 효과가 일부 반영된 결과로 추측된다.
신체 조성 및 근육량과 관련하여 본 연구에서는 8주간의 저항운동 전, 후 시기에 유의한 차이가 나타나지 않았다. 일반적으로 저항운동은 골격근의 양을 증가시키고 체지방률을 감소시키는 효과가 있는 것으로 알려져 있다[ 46, 47]. 하지만 본 연구에서는 체지방률의 유의한 감소나 골격근량의 증가는 나타나지 않았다. 그 이유는 아마도 본 연구에 참여한 대상자들이 과거 10년 이상 보디빌딩을 포함한 다양한 종목에서 운동선수 경험을 한 엘리트 선수 출신들이고 과거 고강도의 트레이닝을 했던 선수들이기에 이 연구에서 처치한 운동 강도 또는 운동량이 부족할 수 있다는 점이고 특히, 일반 임상실험과는 달리 실험 처치 기간 동안 주기적으로 음주와 식이 섭취를 제공했다는 점 등이 신체 조성에 유의한 변화를 가져오기 힘들었기 때문이라고 사료된다. 그 예로, 많은 선행연구[ 48– 50]에서 제시한 바와 같이 알코올은 성장인자, 영양소 및 근력 운동과 같은 근 수축을 포함한 다양한 동화 자극에 대한 반응 뿐 아니라 일반적인 상황에서도 단백질 합성을 억제한다. 부분적으로는 아직 명확하지는 않으나 mTOR 키나제 활성 감소에 의한 단백질 간의 상호작용이 변경될 가능성이 있는 것으로 보고되고 있다[ 48].
결 론
결론적으로 TI+RT와 TI 집단 간의 상호작용으로 인한 처치 효과는 나타나지 않았으나 TI+RT 처치는 GOT, GPT, γ-GTP와 GOT/GPT 비율 모두 유의하게 감소 또는 증가시켜 강황 섭취와 저항 훈련의 시너지 효과 또는 두 처치의 합산 효과(sum of effect)가 있음을 확인할 수 있었다.
향후 연구에서는 저항 훈련량 또는 강황 섭취량에 따른 효과 검증이 필요해 보이며, 또한 무처치 통제집단을 포함시켜 강황 섭취의 단독 효과뿐 아니라 강황 섭취와 저항 훈련의 시너지 효과를 함께 검토하는 것이 필요할 것으로 판단된다.
REFERENCES
1. World Health Organization. 2014 World Organization Report on Alcohol and Health. 2014.
2. National Statistical Office. The annual drinking rate for adults over 19 years of age. 2015.
3. Liguori A, D'Agostino RB, Dworkin SI, Edwards D, Robinson JH. Alcohol effects on mood, equilibrium, and simulated driving. Alcohol Clin Exp Res. 1999;23(5):815-21.   4. Casswall S, Thamarangsi T. Reducing harm from alcohol: call to action. Lancet. 2009;373(9682):2247-57.   5. National Statistical Office. 2016 Cause of death statistics. 2017.
6. An JH. The effect of endurance exercise on reduction of alcohol concentration in blood and fatty liver. KAHPERD. 1999;38(3):497-512.
7. Yang DS, Im YH, Kim CH, Kang JS, Jo JY, et al. The effect of exercise training and ethanol consumption on liver microsome cytochrome P4502E1 and GOT, GPT and LDH in obese Zucker rat. The Korean Journal of Physical Education. 2003;42(5):677-85.
8. Morimoto M, Hagbjoerk AL, Nanji AA, Ingelman-Sundberg M. Role of cytochrome P4502E1 in alcholic liver disease pathogenesis. Alcohol. 1993;10(6):459-64.   9. Nanji AA, Khettry U, Sadrzadeh SMH, Yamanaka T. Severty liver injury in experimental alcoholic liver disease: correlation with plasma endotoxin, prostaglandin E-2, leukotriene B-4, and thromboxane B-2. Am J Pathol. 1993;142(2):367-72.   10. Nanji AA, Hossein Sadrzadeh SM, Khettry U, Thomas P. Protective effects of a novel quinone derivative, (2E)-3-[5-(2,3 dimethoxy-6-methyl-1,4-benzoquinoyl)]-2-nonyl-2-propenoic acid on experimental alcoholic liver injury. J Pharmacol Exp Ther. 1993;266(2):1085-101.  11. Nanji AA, Zhao S, Lamb RG, Sadrzadeh SH, Dannenberg AJ, et al. Changes in microsomal phospholipases and arachidonic acid in experimental alcoholic liver injury: relationship to cytochrome P-450 2E1 induction and conjugated diene formation. Alcohol Clin Exp Res. 1993;17(3):598-603.   12. Fialla AD, Israelsen M, Hamberg O, Krag A, Gluud LL. Nutritional therapy in cirrhosis or alcoholic hepatitis: a systematic review and meta-analysis. Liver Int. 2015;35:2072-8.   13. Mathurin P, O'Grady J, Carithers RL, Phillips M, Louvet A, et al. Corticosteroids improve short-term survival in patients with severe alcoholic hepatitis: meta-analysis of individual patient data. Gut. 2011;60:255-60.   15. Lucey MR, Mathurin P, Morgan TR. Alcoholic hepatitis. N Engl J Med. 2009;360:2758-69.   16. Mansour-Ghanaei F, Pourmasoumi M, Hadi A, Joukar F. Efficacy of curcumin/turmeric on liver enzymes in patients with non-alcoholic fatty liver disease: a systematic review of randomized controlled trials. Int Med Res. 2019;8(1):57-61.  17. Goodarzi R, Sabzian K, Shishehbor F, Mansoori A. Does turmeric/curcumin supplementation improve serum alanine aminotransferase and aspartate aminotransferase levels in patients with nonalcoholic fatty liver disease? a systematic review and meta-analysis of randomized controlled trials. Phytotherapy Res. 2019;33(3):561-70.  18. Shamsoddini A, Sobhani V, Chehreh MEG, Alavian SM, Zaree A. Effect of aerobic and resistance exercise training on liver enzymes and hepatic fat in iranian men with nonalcoholic fatty liver disease. Hepatitis Monthly. 2015;15(10):e3143-50.  19. Navekar R, Rafraf M, Ghaffari A, Asghari-Jafarabadi M, Khoshbaten M. Turmeric supplementation improves serum glucose indices and leptin levels in patients with nonalcoholic fatty liver diseases. J Am Nut. 2017;36(4):261-7.  20. Rahmani S, Asgary S, Askari G, Keshvari M, Hatamipour M, et al. Treatment of non-alcoholic fatty liver disease with curcumin: a randomized placebo-controlled trial. Phytotherapy Res. 2016;30(9):1540-8.  21. Slentz CA, Bateman LA, Willis LH, Shields AT, Tanner CJ, et al. Effects of aerobic vs. resistance training on visceral and liver fat stores, liver enzymes, and insulin resistance by HOMA in overweight adults from STRRIDE AT/RT. American Journal of Physiol Endocrinol Metab. 2011;301(5):E1033-9.  22. Hwang SK. The right path to health. Seoul: Keum Kwang 1997.
23. Anderes Goth MD. Medical pharmacology. The C.V. Mosby Company 1984.
24. Xu Y, Ku BS, Yao HY, Lin YH, Ma X, et al. The effects of curcumin on depressive-like behaviors in mice. Eur J Pharmacol. 2005;518(1):40-7.  25. Aggarwal BB, Surh YJ, Shishodia S. The molecular targets and therapeutic uses of curcumin in health and disease. 595: Springer Science & Business Media 2007.
26. Kang WS, Kim JH, Park EJ, Yoon KR. Antioxidative property of turmeric (Curcuma rhizoma) ethanol extract. Food Sci Tech. 1998;30(2):266-5.
27. Amon HPT, Wahl MA. Pharmacology of Curcumalonga. Planta Med. 1991;57(1):1-7.  28. Choi SW, Yang JS, Lee HS, Kim DD, Bae DH, et al. Characterization of squalene synthase inhibitor isolated from curcuma longa. Food Sci Tech. 2003;35(2):297-5.
29. Jarahzadeh M, Hosain D. The effect of Turmeric on lipid profile, malondialdehyde, liver echogenicity and enzymes in patients with non-alcoholic fatty liver [thesis]. Iran. Ahvaz Jundishapur university. 2017.
30. Widmark EMP. Die theoretischen Grundlagen und die praktische verwendbarkeit der gerichtlich-medizinischen alkoholbestimmung. Urban & Schwarzenberg 1932.
31. American College of Sports Medicine. American College of Sports Medicine position stand. Progression models in resistance training for healthy adults. Med Sci Sports Exerc. 2009;41(3):687-708.  32. Mukai M, Ozasa K, Hayashi K, Kawai K. Various S-GOT/S-GPT ratios in nonviral liver disorders and related physical conditions and lifestyle. Dig Dis Sci. 2002;47(3):549-55.  33. Okubo A, Kameyama S. The transaminase (aminotransferase). In the approach of determination of serum enzyme to abnormal-disease state. In Kitamura M (Ed.), Igakushoin 1985;(pp. 1-28).
34. Colon JA, Kaplan MM. The SGOT/SGPT ratio: An indicator of alcoholic liver disease. Dig Dis Sci. 1979;24(11):835-8.  35. Lamy J, Baglin MC, Weill J, Aron E. Serum gamma-glutamyltranspeptidase and alcoholism. Diagnosis and control of withdrawal. Nouv Presse Med. 1975;4(7):487-9.  36. Matsuda Y, Tsuchishima M, Ueshima Y, Takase S, Takada A. The relationship between the development of alcoholic liver and pancreatic diseases and the induction of gamma glutamyl transferase. Alcohol Alcohol Suppl. 1993;28(Supplement_1B):27-32.  37. Yokoyama H, Hirose H, Moriya S, Saito I. Significant correlation between insulin resistance and serum gamma-glutamyl transpeptidase (r-GTP) level in non-drinkers. Alcohol Clin Exp Res. 2002;26:91-4.
38. Jeong DM. The effect of long term exercise on liver function of fatty liver patients: by data analysis of GPT, GOT, γ-GTP [thesis]. Seoul. Kyung hee University. 2001.
39. Lee CH, Yang CY, Cho MJ. Effects of fermented turmeric extracts on the obesity in rats fed a high-fat Diet. J Ani Sci Tech. 2011;53(1):75-81.  40. Bastien M, Poirier P, Brassard P, Arsenault BJ, Bertrand OF, et al. Effect of PPARgamma agonist on aerobic exercise capacity in relation to body fat distribution in men with type 2 diabetes mellitus and coronary artery disease: a 1-yr randomized study. Am J Physiol Endocrinol Metab. 2019;317(1):65-73.
41. Codella R, Ialacqua M, Terruzzi I, Luzi L. May the force be with you: why resistance training is essential for subjects with type 2 diabetes mellitus without complications. Endocrine. 2018;62(1):14-25.   42. Holten MK, Zacho M, Gaster M, Juel C, Wojtaszewski JF, et al. Strength training increases insulin-mediated glucose uptake, GLUT4 content, and insulin signaling in skeletal muscle in patients with type 2 diabetes. Diabetes. 2004;53(2):294-305.   43. Castaneda C, Layne JE, Munoz-Orians L, Gordon PL, Walsmith J, et al. A randomized controlled trial of resistance exercise training to improve glycemic control in older adults with type 2 diabetes. Diabetes Care. 2002;25(12):2335-41.   44. Moriya S, Yokoyama H, Hirose H, Ishii H, Saito I. Correlation between insulin resistance and gamma-glutamyl transpeptidase sensitivity in light drinkers. Alcohol Clin Exp Res. 2003;27:52-7.
45. Kim MS. Effects of aerobic exercise and sauna therapy on blood alcohol concentration and liver function enzymes after hangover [thesis]. Daegu. Keimyung University. 2018.
46. Hartman JW, Moore DR, Phillips SM. Resistance training reduces whole-body protein turnover and improves net protein retention in untrained young males. Appl Physiol Nutr Metab. 2006;31(5):557-620.   47. Ramírez-Campillo R, Andrade DC, Campos-Jara C, Henríquez-Olguín C, Alvarez-Lepín C, et al. Regional fat changes induced by localized muscle endurance resistance training. J Strength Cond Res. 2013;27(8):2219-32.   49. Steiner JL, Lang CH. Alcohol intoxication following muscle contraction in mice decreases muscle protein synthesis but not mTOR signal transduction. Clinic Exp Res. 2015;39(1):1-10.  50. Duplanty AA, Budnar RG, Luk HY, Levitt DE, Hill DW, et al. Effect of acute alcohol ingestion on resistance exercise-induced mTORC1 signaling in human muscle. J Str Con Res. 2017;31(1):54-61. 
|
|







