서 론
파킨슨 질환(Parkinson’s Disease, PD)은 1817년 제임스 파킨슨의 저서 “An Essay on the Shaking Palsy”에서 처음 기술된 질환으로써 알츠하이머 질환 다음으로 가장 흔한 신경퇴행성 질환으로 운동완서, 자세 불안정, 휴식 시 진전 및 강직 등의 운동증상이 보이며, 주로 60세 이상에서 높게 발병한다[1-3]. 전세계적으로 인구 10만 명당 4.5-19명에게 이 질환이 발생하는 것으로 보고되었으며[4], 우리나라의 경우 2004년 3만798명에서 2012년 7만4627명으로 2.4배 증가한 것으로 보고되어 노인인구 증가와 함께 이 질환의 관심이 높아지고 있다[5].
PD의 발병 원인은 아직까지 명확하게 밝혀지지 않았으나 병리적 특징은 흑질(substantia nigra pars compactra, SNpc) 내 도파민 세포의 특이적 손실과 루이소체(Lewy bodies, LBs)라 불리는 단백질 응집체의 존재이다[6,7]. SNpc와 복측피개(ventral tegmental area)의 도파민 신경 세포는 인간의 감정과 행동을 조절하기 때문에 지속적인 감소는 PD의 운동증상을 야기한다고 보고된다[8,9]. 한편, LBs는 비정상적으로 응집된 α-synuclein 단백질이 주된 구성요소이다[10]. α-synuclein 단백질은 용해성 있는 고도로 보존된 단백질로 아미노산 약 140개 길이의 뇌단백질로써, 시냅스 전 종말(pre-synaptic nerve terminal)에 위치하여 시냅스의 유지 및 샤페론(chaperon)활성에 관여한다[11,12]. 신경 세포 또는 신경교세포(glial cell)에서 야기된 α-synuclein의 비용해성 비정상적인 축척을 synucleinopathy라 하며, PD를 포함한 신경퇴행성 질환의 특징이기도 하다[13]. Feany et al. [14]는 변성된 인간 α-synuclein을 과발현 시킨 유전자이식 초파리 모델에서 점진적인 운동기능장애와 도파민성 신경세포소실 및 세포질내봉입체(intracytoplasmic inclusion)인 LBs를 보고하였으며, 이 연구는 α-synuclein의 감소 혹은 억제가 PD의 치료에 중요한 목적임을 시사한다.
α-synuclein 단백질은 SNCA gene에 의해 암호화 되며, 발현되는 과정에서 SNCA messengerRNA (mRNA)의 번역을 조절하는 microRNA (miRNA; miR)가 밝혀졌다[15,16]. 전사 후 조절자로 알려져 있는 miRNA는 약 19-25 nt (nucleotide) 크기의 단백질을 번역하지 않는 small noncoding RNA로써 표적 mRNA의 번역을 억제하거나 분해하여 유전자 발현을 조절한다[17]. miRNA의 생합성 기전은 먼저, 핵 내에서 RNA polymerase Ⅱ에 의해 헤어핀(hairpin) 구조의 primary miRNA (pri-miRNA)가 생성되고 nuclear RNAase인 Drosha가 pri-miRNA를 약 70 nt 길이로 잘라내어 precursor-miRNA (pre-miRNA)로 만든다[18,19]. pre-miRNA가 Exportin 5를 통해 세포질로 이동하면 Dicer RNAase III endonuclease가 hairpin구조를 잘라내어 mature miRNA가 생성되고, RNA-induced silencing complex (RISC)와 결합하여 전사 후 조절자로서 주로 표적 mRNA의 3´-untranslated region (UTR)에 반응하여 발현에 영향을 미친다[20,21].
miRNA는 생체지표(biomarker)로서 세포의 성장, 분화, 세포사멸, 조혈 및 종양형성에 중요한 역할을 하며[22,23], Barbato et al. [24]과 Bilen et al. [17]은 특히 신경퇴행성 질환에서 miRNA의 역할을 강조하였다. Junn et al. [16]은 파킨슨 동물 모델과 세포배양을 통해 중뇌 miR-7의 과발현은 α-synuclein 단백질 수준을 감소시키며, miR-7 억제제(inhibitor) 작용 시 α-synuclein 단백질 수준의 증가를 보고하여 PD의 치료표적으로서 miR-7을 제안하였다. 또한 Doxakis [15]는 miR-7과 miR-153의 과발현이 SNCA mRNA의 수준과 내재성 α-synuclein 단백질 수준을 감소시킨다고 밝혀내 가족성 또는 특발성 파킨슨 질환의 환자들에게 새로운 치료 방법일 것이라고 제안하였으며, miR-7과 miR-153이 1-Methyl-4-Phenyl-Pyridinium (MPP+)로 유도한 파킨슨 질환 세포모델에서 세포사멸(apoptosis)로부터 신경세포를 보호한다는 최근 연구도 파킨슨 질환에서 miRNA의 치료적 가능성을 뒷받침하고 있다[25].
PD의 병리와 치료를 위한 연구는 분자생물학적, 생화학적 방법을 통해 동물모델을 이용하고 있으며, 그 중 1982년 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP)에 오염된 헤로인을 투약한 마약 중독자 무리에게서 파킨슨 질환과 유사한 임상적 특징이 나타난 것이 밝혀짐에 따라[26] 이와 관련된 동물실험 연구가 활발히 진행되고 있다. Jackson-Lewis et al. [27]는 MPTP를 투여한 파킨슨질환모델에서 흑질 및 선조체의 도파민 수준과 tyrosine hydroxylase (TH)의 변화를 제시하였으며, MPTP를 이용한 마우스 모델의 단계적 프로토콜을 제시하였다. MPTP는 선택적으로 흑질의 도파민 세포를 파괴하는데, 높은 친유성으로 뇌혈관관문(Brain-Blood-Barrier)을 통과하여 별 아교 세포(astrocyte)의 효소인 monoamine oxidase B (MAO-B)에 의해 대사산물인 MPP⁺ (1-methyl-4-phenylpyridinium)로 전환된다[28,29]. Dopamine transporter (DAT)를 통해 도파민 세포로 이동한 MPP⁺는 미토콘드리아 내막 전자전달계 복합체Ⅰ(complexⅠ )의 기능을 억제하여 에너지 대사 항상성을 붕괴시키고, 산화적 스트레스(oxidative stress)를 발생시키며, 증가된 세포내 활성산소종(Reactive Oygen Species)이 α-synuclein의 비정상적 응집에 관여하고 결국 세포사멸을 일으킨다[30,31].
현재 PD의 치료 방법은 약물치료와 외과적 수술이 시행되고 있다. 약물치료의 목적은 도파민세포 소실로 인한 도파민 부족의 보충으로, 대표적인 예는 도파민의 전구물질인 레보도파(Levo dopa; L-dopa)의 투여로써 운동증상 완화에 효과가 보고되지만[7], 투여된 L-dopa의 약 90%가 뇌혈관관문(Brain-Blood-Barrier)을 통과하지 못하며[32], 장기투여 시 운동 합병증(motor complication)을 일으킨다고 보고된다[33]. 또한 외과적 치료는 약물 치료에 반응은 있으나 적절히 치료되지 않거나 부작용이 있을 때 또는 약물복용이 어려울 때 시행되므로 증상완화 이상의 효과는 기대하기 어렵다. 한편, 운동은 PD에 효과적이라고 알려져 있는데, Bergen et al. [34]은 파킨슨 질환 환자를 대상으로 실시한 주 3회 16주간의 유산소성 운동 운동개시(movement initiation)의 변화로 운동능력 향상시킨다고 보고하였으며, Picelli et al. [35]은 주 3회 4주 간의 보행훈련이 파킨슨 질환 환자의 자세 안정성을 개선시킨다고 보고하는 등 임상적 증상 개선을 통해 치료의 대안으로써 운동을 제안하였다. 특히, 운동이 PD에서 인지능력, 세포 내 미토콘드리아 기능 및 신경화학적 요인을 개선시킨다는 연구들이 상당수 발표되었다[36,37]. Tuon et al. [38]이 보고한 트레드밀 운동으로 인한 파킨슨 질환 동물모델의 선조체 내 α-synuclein 수준의 감소 및 TH의 증가와 Ahmad et al. [39]의 지구성 운동이 만성 파킨슨 질환 동물모델의 복측피개 도파민성 신경세포를 보호한다는 결과는 운동이 PD의 병리적 특징에 미치는 긍정적 영향을 제시하고 있다.
운동이 건강한 삶을 유지하는 방법이라는 것은 많은 연구들을 통해 이미 증명 되어 왔다. 그 중 유산소 운동이 신경퇴행성 질환의 증상 개선에 효과적이라는 보고가 증가하고 있는 실정에서 직접적으로 신경독성의 단백질 발현을 억제하는 miRNA와 운동에 관련된 연구는 아직까지 이루어지지 않았다. 특히, PD의 발병기전이 명확하지 않은 현시점에서 뇌신경조직의 분자적 수준의 연구는 중요하므로 운동과 PD의 연관성을 규명하기위해 대표적인 특징인 α-synuclein 단백질의 mRNA 발현을 조절하는 miR-153의 수준에 대한 연구는 그 근거를 명확하게 할 뿐만 아니라 비약물적 치료의 새로운 패러다임을 제시할 수 있을 것이다.
따라서 본 연구는 PD의 치료와 증상진행의 지연을 위한 관점에서 지구성 운동이 MPTP로 유도한 파킨슨 질환 동물모델의 선조체에서 α-synuclein 단백질과 miR-153의 발현 및 운동기능을 규명하고자 한다.
연구 방법
1. 실험 동물
본 실험에 사용된 실험동물은 C57BL/6 마우스(n=21)를 분양 받아 1964년 발표한 헬싱키 선언에 근거한 Guiding Principles for the care and Use of Animal에 따라 온도(23±1˚C), 습도(40-60%) 및 주간(09:00-21:00)에는 점등, 야간(21:00-09:00)에는 자동적으로 소등되는 조명 시설을 갖춘 K대학교 동물실험실에서 사육하였다. 실험기간 동안 미국 영양학회에서 발표된 AIN-76A 실험동물용 식이조정에 따라 제조된 사료(Purina 쥐사료 - 5057)를 제공하였고 식이량과 수분 섭취는 제한 없이 공급하였다.
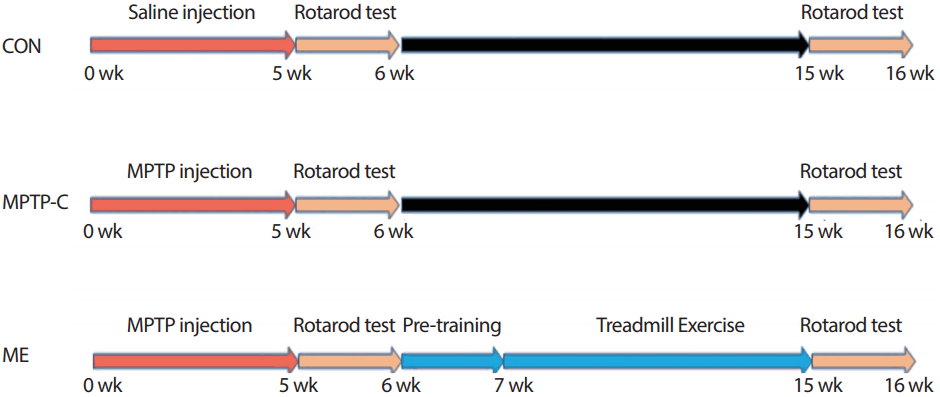
실험 집단은 생리식염수를 투여하는 CON (C57/BL6 control, n=7), MPTP-C (MPTP control, n=7) 및 ME (MPTP+Exercise, n=7)으로 총 3집단으로 구분하였으며, 모든 실험절차 및 방법은 K대학교 동물실험 윤리위원회의 승인을 거쳐서 진행하였다.
2. 연구절차
1) 파킨슨 질환 마우스 모델 및 운동방법
만성 파킨슨 질환을 유도하기 위해 Lau [40]가 제시한 방법을 적용하여 복강 내에 20 mg/kg의 MPTP (Sigma-Aldrich, USA)와 흡수를 돕기 위해 Probenecid (Sigma-Aldrich, USA) 250 mg/kg을 주 2회 5주간 총 10회 복강(intraperitoneal)에 투여하였다.
2) 운동 기능 검사
Rotarod (five lnin acclerating retarod; JD-A-07, Jeung do, Korea) 트레드밀을 이용하여 균형감각을 검사하였다. 동물모델을 올려놓고 속도 4 rpm으로 시작하여 점차적으로 속도를 증가시켜 300초 후 40 rpm까지 점증적으로 작동하게 한 후, 트레드밀이 돌아가도록 하였을 때, 동물이 균형을 잃고 바닥에 떨어질 때까지의 시간을 측정하였다.
3) 뇌 조직 적출
8주간 트레드밀 운동과 운동기능검사를 수행한 후, Zoletil50 (Virbac Laboratories, Carros, France)과 Rompun (Bayer, Kansas, USA)을 혼합하여 50 mg/kg을 복강 내 주입시켜 마취 시킨 후, 뇌 조직을 적출하여 분석 시 까지 -80˚C 초저온냉동고(Deep Freezer, SANYO, Janpen)에서 보관하였다.
4) Total RNA 분리 및 역전사효소반응
적출한 뇌 조직에서 total RNA를 분리하기 위해 mirVana™ miRNA Isolation Kit (Ambion, CA, USA)를 이용하였다. 분리방법은 Kit의 protocol로 진행하였으며, 역전사효소반응 전까지 -20˚C에서 보관하였다. 분리하여 냉동보관 된 각 집단의 total RNA의 순도는 Nano-drop2,000 (Thermo Scientific, Wilmington, DE, USA)을 이용하여 흡광도를 측정하였으며, A260/A280의 비율이 1.8-2.1인 sample을 선택하여 농도(μg/μL)를 계산하였다. 역전사를 위해 TaqManⓇ MicroRNA Reverse Transcription Kit (Ambion, CA. USA)를 이용하여 cDNA를 만들고 -20˚C에서 보관하였다.
5) Quantitative Real-Time PCR
집단 간 miRNA와 mRNA의 발현을 비교하기 위해 Real-time PCR을 수행하였다. 분석방법은 TaqMan® Universal Master Mix II, no UNG (Applied Biosystem, CA, USA)와 Nuclease-free water를 넣어 가볍게 섞어준 뒤 spin-down하고 miRNA는 TaqManⓇ MicroRNA Assay (Applied Biosystem, CA, USA, ID:001191, mmu-miR-153-3p), mRNA는 TaqManⓇ Gene Expression Assay (Applied Biosystem, CA, USA, ID:Mm01188700_m1)와 cDNA를 넣어 가볍게 spin-down하였다. Real-time PCR system (7900 Fast Real-Time PCR System, Applied Biosystems, CA, USA)을 이용하여 384 plate에 각 sample당 3번씩 반복하였으며, activation 95˚C에서 10분, denature 95˚C에서 15초, Annealing 60˚C에서 60초의 한 cycle을 총 40 cycle 진행한 후 DataAssistTM Software에서 endogenous control RNU6-2 (Applied Biosystem, CA, USA, ID: 001973, U6 RNA)를 이용하여 각 sample과 상대적 CT (ΔΔCT)값을 비교한 후 값을 산출하였다.
6) SDS-PAGE
단백질을 추출하기 위해 막자사발에서 액화질소와 함께 파쇄하고 Protein Extaction Solution-RIPA (ELPIS biotech, Korea)와 혼합하여 균질화 시킨 뒤 원심분리기(Micro-centrifuge, 5417R, Eppendorf)를 이용하여 원심분리(14,000 rpm, 30분) 한 후 상청액을 얻었다. 각 단백질의 분자량에 따라 8%와 15%의 separating gel (3 DW, 30% acrylamide: bisacrylamide, 1.5 M tris pH 8.8, 10% SDS, TEMED, 10% Ammonium persulfate)과 5% stacking gel (3DW, 30% acrylamide: bisacrylamide, 1M tris pH 6.8, 10% SDS, TEMED, 10% Ammonium persulfate)을 SDS-PAGE에 사용하였다. 원심분리하여 얻은 상청액과 5X Sample loading buffer (0.375 M Tris-HCl, pH6.8, 5% SDS, 5% β-mercaproethanol, 50% glycerol, 0.05% bromophenol blue)을 4:1 비율로 잘 혼합한 후 95˚C에서 10분간 끓여 단백질을 변성시킨 후 10분간 ice에서 cooling하고, spin down 하였다. Protein size marker (ELPIS biotech, Korea)와 함께 각 샘플을 Mini-Protein Ⅱ dual-slab apparatus (Bio-Rad, CA, USA)에 준비된 stacking gel well에 각 샘플을 분주하고 80 volt에서 바닥에 내려올 때까지 전기 영동하였다.
7) Immunoblotting analysis
Polyvinylidine difluoride (PVDF) membrane을 MeOH에 적셔 activation 시킨 후에 Transfer buffer (190 mM glycine, 50 mM Tris-base, 0.05% SDS, 20% methanol)로 washing 한 후에 Transfer buffer에 적신 whatman 3 M paper를 차례로 겹쳐 Mini trans-bolt cell (Bio-Rad, CA, USA)에 장치한 후 200 mA로 90분 전사하고 Membrane으로 증착이 끝나면 platform shaker 위에서 60분 동안 membrane을 5% BSA용액(in TBS-T: 10 mM tris-base pH 8.0, 150 mM NaCl, 0.1% Tween-20)으로 Blocking 하였다. 1차 항체인 anti-α-synuclein (BD bioscience, CA, USA), anti-Tyrosine hydroxylase (Millipore, CA, USA)를 1:1,000으로 5% BSA 용액에 각각 희석시켜 12시간 동안 흔들어 주고 난 다음 0.1% TBS-T 용액으로 세척한 후 2차 항체(horseradish peroxidase-conjugated goat anti-rabbit, Invitrogen, CA, USA; horseradish peroxidase-conjugated goat anti-mouse, Santa Cruz, USA)를 Blocking 용액으로 1:5,000으로 희석시켜 90분 동안 흔들어 주고 난 다음 TBS-T 용액으로 7분씩 4차례 세척하였다. 마지막 단계로 LuminataTM Forte Western HRP Substrate (Millipore, Mass, USA)에 membrane을 넣고 1분간 발색시킨 membrane은 이미지 분석 시스템(Molecular Imager ChemiDoc XRS System, Bio-Rad, USA)을 이용하여 스캔한 후 Quantity One 1-D Analysis Software (Bio-Rad, USA)를 이용하여 단백질량을 산출하였다.
8) Immunohistochemistry (IHC)
면역조직화학법은 자유부유법(free-floeting method)을 이용하여 각 집단에서 최소 12장 이상을 선택하여 50 mM PBS로 peroxidase 제거를 위해 과산화수소(H2O2)에서 30분간 반응시킨 후 50 mM PBS로 세척하였다. 그리고 1시간 동안 1% BSA와 10% donkey serum 및 3% Triton X-100이 들어있는 용액으로 1시간동안 blocking을 실시하였다. Blocking 후 1차항체를 24시간 동안 4˚C에서 반응시켰다. 그리고 50 mM PBS로 세척한 후 실온에서 1시간 동안 Biotinylated goat secondary antibody (Vector Laboratories, Burlingame, CA, USA)로 반응시켰다. 다시 50 mM PBS로 세척한 후 1시간을 avidin-biotin-peroxidase complex (Vectastain-Elite ABC kit, Vector Laboratories) 용액으로 상온에서 1시간 동안 반응 시킨 후 50 mM PBS로 세척한 후, diaminobenzidine (DAB, Vector Laboratories, Burlingame, CA, USA)를 0.05 M trisbuffer (pH 7.6)에 0.02%로 희석하고, 0.02%의 과산화수소를 첨가하여 3분 동안 발색하였다. 발색이 끝난 조직은 gelatin-coating된 슬라이드에 붙인 후 실온에서 24시간 건조시켜 70%, 80%, 90%, 100%로 농도를 높인 에탄올에서 탈수시켰다. 탈수과정이 끝나면 xylene으로 투명화시켜 Permount를 사용하여 봉입한 후 광학현미경으로 관찰하였다.
3. 자료처리방법
이 연구에서 얻어지는 모든 결과는 SPSS Statistics 18.0 통계 프로그램을 이용하였으며, 각 변인들에 대한 기술통계치인 평균±표준편차(Mean±SD)를 산출하였다.
각 집단 간 변인의 차이를 확인하기 위해서 일원변량분석(One way ANOVA)을 실시하였으며, 그 차이를 구체적으로 확인하기 위해 LSD(Least Significant Difference)를 이용하여 사후 검증을 실시하였다. 또한 집단 별 처치 전 검사는 독립 t-test를 통해 비교하였으며, 모든 검증의 통계적인 유의수준은 α<.05로 설정하였다.
연구 결과
1. 집단 간 Rotarod test 수행 능력
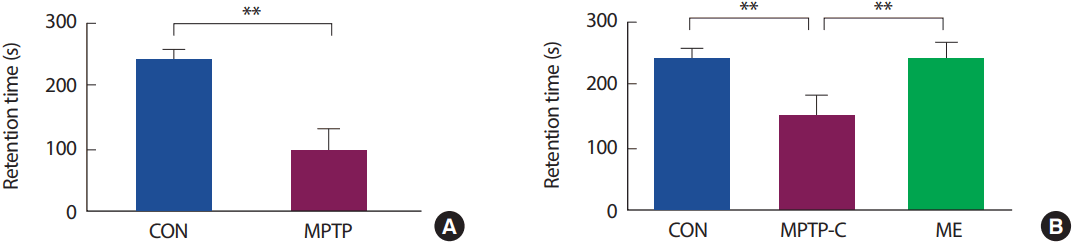
MPTP로 유도한 PD 쥐를 대상으로 8주간의 지구성 운동 처치 전후에 집단 간 운동기능을 검사한 결과(Fig. 2), 사전 검사에서 CON 집단은 242.286±13.506 seconds, MPTP-C 집단은 100.250±29.193 seconds으로 나타났으며, 집단 간 rotarod treadmill을 유지한 시간은 통계적으로 유의한 차이가 있는 것으로 나타났다[t=12.122, p<.001]. 또한, 8주간의 지구성 운동을 처치한 사후검사에서 CON 집단은 247.571±17.952 seconds, MPTP-C 집단은 151.714±35.312 seconds, ME 집단은 244.286±28.843 seconds으로 나타났으며, 집단 간 통계적으로 유의한 차이가 있는 것으로 나타났다[F(2,20)=25.901, p<.001]. 사후검증 결과 MPTP-C 집단은 CON 집단에 비해 유의하게 감소하였으며(p<.001), ME 집단은 MPTP-C 집단에 비해 유의하게 증가하였다(p<.001).
2. 집단 간 선조체에서 miR-153과 SNCA mRNA의 발현 수준
MPTP로 유도한 PD 쥐를 대상으로 8주간의 지구성 운동을 처치한 후 선조체 내 mir-153과 SNCA mRNA의 발현량을 분석한 결과(Fig. 3), miR-153의 발현 수준은 집단 간 통계적으로 유의한 차이가 나타났다[F(2,14)=17.875, p<.001]. 사후검증 결과 MPTP-C 집단은 CON 집단에 비해 유의하게 감소하였으며(p<.001), ME 집단은 MPTP-C 집단에 비해 유의하게 증가하였다(p<.05).
SNCA mRNA의 발현 수준은 집단 간 통계적으로 유의한 차이가 나타났다[F(2,14)=275.847, p<.001]. 사후검증 결과 MPTP-C 집단과 ME 집단은 CON 집단에 비해 유의하게 증가하였으며(p<.001), ME 집단은 MPTP-C 집단에 비해 유의하게 감소하였다(p<.05).
3. 집단 간 선조체에서 α-synuclein 발현 수준
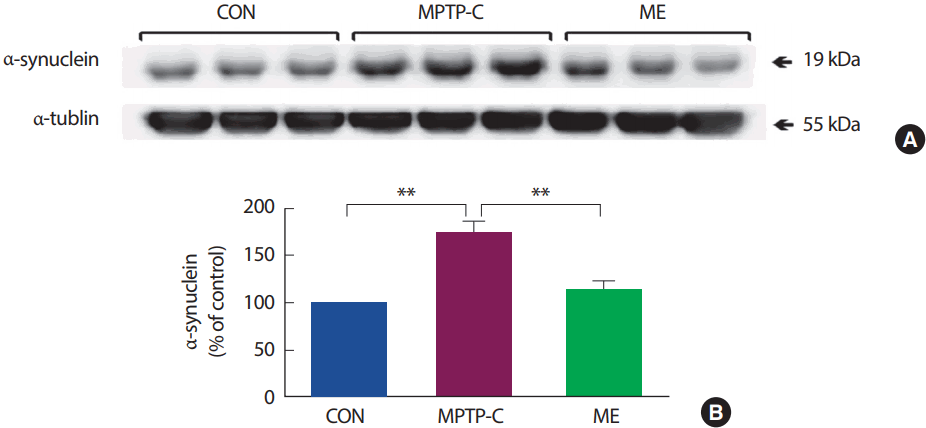
MPTP로 유도한 PD 쥐를 대상으로 8주간의 지구성 운동을 처치한 후 선조체에서 α-synuclein 단백질의 발현량을 분석한 결과(Fig. 4), 집단 간 통계적으로 유의한 차이가 나타났다[F(2,14)=26.349, p<.001]. 사후검증 결과 MPTP-C 집단은 CON 집단에 비해 유의하게 증가되었으며(p<.001), ME 집단은 MPTP-C 집단에 비해 유의하게 감소되었다(p<.001).
4. 집단 간 선조체에서 tyrosine hydroxylase 발현수준
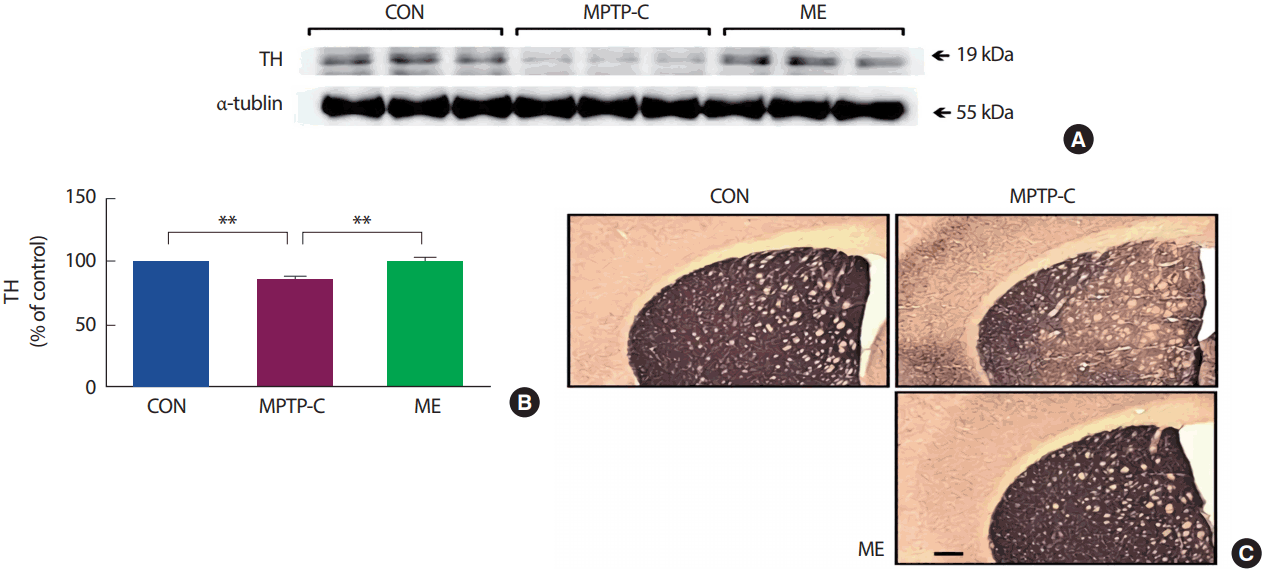
MPTP로 유도한 PD 쥐를 대상으로 8주간의 지구성 운동을 처치한 후 선조체에서 Immuno blotting과 IHC실험을 통해 TH 단백질의 발현을 분석한 결과(Fig. 5), 집단 간 통계적으로 유의한 차이가 나타났다[F(2,14)=32.357, p<.001]. 사후검증 결과, MPTP-C 집단은 CON 집단에 비해 유의하게 감소하였으며(p<.001), ME 집단은 MPTP-C 집단에 비해 유의하게 증가하였다(p<.001).
논 의
파킨슨 질환(PD)은 19세기 처음 명명된 이래로 고령인구와 함께 발병률이 꾸준히 증가하고 있는 신경퇴행성질환으로 아직까지 명확한 치료방법이 없는 실정이다. 따라서 본 연구는 치료대안으로 운동을 제시한 선행연구와 최근 밝혀진 miRNA의 정보를 토대로 트레드밀 운동이 파킨슨 질환 동물 모델의 병리적 특징과 miRNA 발현에 미치는 영향을 규명하고자 하였다.
PD의 임상적 특징인 운동완서, 휴식 시 진정 및 자세 불안정 등의 운동증상은 흑질 내 도파민 세포의 선택적 소실로 인해 선조체 도파민 수준이 약 70% 감소하면 나타나는 대표적인 임상적 특징이다[41]. 따라서 MPTP로 유도한 PD 동물모델의 운동능력을 분석하기 위해 움직임 협응력(motor coordination) 평가에 사용되는 rotarod 테스트를 지구성 운동 수행 사전 및 사후에 실시하였다. 본 연구 결과 트레드밀 운동 전 실시한 rotarod 테스트에서 MPTP-C 집단의 rotarod treadmill 유지시간이 CON 집단에 비해 통계적으로 유의하게 감소하는 것으로 나타났으며, 이 결과는 MPTP가 도파민 수준을 감소시켜 운동기능을 저하시킨다는 보고와 일치하였다[42,43]. 반면, 트레드밀 운동 후 실시한 rotarod 테스트 결과에서는 지구성 운동을 수행한 ME 집단이 MPTP-C 집단에 비해 rotarod treadmill 유지시간이 통계적으로 유의하게 증가하였으며, 트레드밀 운동이 MPTP로 유도한 PD 실험동물의 도파민 수준을 증가시켜 운동기능을 향상시킨다고 보고한 Gorton et al. [44], Petzinger et al. [45]의 연구와 일치하였다.
선행연구들과 본 연구의 운동 기간과 강도, MPTP 투여량 및 기간이 다름에도 운동기능 회복의 결과가 나타난 것은 트레드밀 운동이 파킨슨 질환의 운동기능을 향상시키는 상당한 효과가 있다고 생각된다. 그러므로 운동의 강도와 기간 및 회복 정도의 관련성을 후속 연구를 통해 검증하고 pole test, hanging test와 같은 다양한 운동기능 검사를 추가하여 다각적인 운동증상의 개선 정도를 살펴볼 필요가 있겠다.
miRNA는 생물학 전반의 다양한 프로세스에 중심적 역할을 수행한다고 보고되며[46], 현재 miRBase (http://www.mirbase.org/)에 따르면 약 1,000개 이상의 miRNA가 보고되어 있다. PD의 병리와 관련되어 있다고 알려진 miRNA는 miR-7, miR-133b, miR-153, miR-433. miR184 등이 있으며[18], 이 중 miR-7과 miR-153은 MPTP로 유도한 생쥐 및 MPP⁺로 처치한 세포모델에서 α-synuclein의 발현을 억제한다고 실험적으로 증명되었다[47]. α-synuclein은 파킨슨질환에서 가장 광범위하게 연구되는 단백질로서 염색체 4번의 엑손(exon) 7개로 구성된 단일 유전자에서 인코딩 되며[48], Maroteaux et al. [49]이 처음으로 기록하였다. 이 단백질의 생리학적 기능은 아직까지 명확하게 알려져 있지 않지만 도파민 생합성, 시냅스 가소성 등에 관련된 역할을 수행한다고 보고되고 있다[50]. 내생의 α-synuclein은 정상적으로 58 kDa의 사량체 구조로 존재하지만[51] 불균형한 생성과 분해로 인한 비정상적인 과발현은 독성으로 작용하여 유전적, 특발성 PD 모두에서 도파민 신경세포사멸을 촉진한다고 알려져 있다[52]. 따라서 α-synuclein의 발현을 정상적으로 조절하는 miRNA의 역할은 PD의 병리에 매우 중요하다고 생각된다.
α-synuclein의 발현을 억제한다고 알려진 miR-153의 발현수준을 분석한 결과 MPTP-C 집단이 CON 집단에 비해 통계적으로 유의하게 감소하였으나 SNCA mRNA 발현수준은 MPTP-C 집단이 CON 집단에 비해 통계적으로 유의하게 증가하였다. 이 결과는 MPP⁺를 처치한 세포를 대상으로 miR-153과 SNCA mRNA 수준을 비교한 Doxakis [15]의 결과와 일치하며, CON 집단에 비해 MPTP 집단은 α-synuclein 발현을 억제할 수 있는 분자생물학적 단계의 mechanism이 감소된 것으로 생각된다. 또한 ME 집단은 MPTP-C 집단에 비해 miR-153의 발현수준은 증가하였으나 SNCA mRNA 발현수준은 감소하였다. 이 결과는 트레드밀 운동이 miR-153의 발현 증가에 영향을 미쳐 SNCA mRNA를 감소시키는 것으로 즉, α-synuclein 단백질로의 번역 전 과정에 영향을 미친다고 생각된다.
SNCA mRNA의 결과에 따라 α-synuclein의 발현량을 알아보기 위해 immunoblotting을 실시하였다. 본 연구에서 α-synuclein 단백질은 MPTP-C 집단이 CON 집단 보다 통계적으로 유의하게 증가하였으며, ME 집단은 MPTP-C 집단에 비해 통계적으로 유의하게 감소한 것으로 나타났다. 앞서 SNCA mRNA의 발현 경향과 비슷한 것은 운동 처치로 인해 miR-153이 증가됨에 따라 SNCA mRNA의 번역을 감소시켜 α-synuclein 단백질로의 발현이 감소된 것으로 생각된다.
본 연구는 miR-153과 SNCA mRNA 및 α-synuclein로 이어지는 단백질 합성경로에서 운동처치에 대한 변화를 각각 살펴보았다. α-synuclein은 PD의 발병에 중심적 역할을 수행하며, 이 단백질의 적절한 합성과 분해를 조절하는 것은 신경세포의 기능과 생존에 매우 중요하다고 보고된다[52]. 따라서 트레드밀 운동이 α-synuclein을 감소시켜 PD의 병리적 상태를 완화시킬 수 있는 치료적 가능성을 확인 하였으므로 이 단백질을 억제시킨다고 알려진 또 다른 miRNA인 miR-7을 추가적으로 연구하여 트레드밀 운동의 효과를 검증할 필요가 있겠다.
도파민은 카테콜라민계 신경전달물질로 SNpc와 VTA의 중뇌 신경세포로 부터 합성되며, 이들 핵에서 비롯된 도파민 신경세포는 선조체, 대뇌피질 및 변연계로 뻗어나간다[53,54]. Tyrosine hydroxlyase (TH)는 도파민 합성과정에서 도파민 전구체인 3,4-dihydroxy-L-phenylalanine (L-DOPA) 생성을 촉진하는데 기여하는 속도제한효소로서 PD의 선조체에서 이 효소가 결핍되어 있다고 보고된다[55,56]. 게다가 상당수 연구들은 α-synuclein과 TH가 PD의 병리 및 도파민성 신경전달에 상호연관성이 존재한다고 밝혔으며[57], α-synuclein의 과발현 시 TH의 기능에 영향을 미쳐 도파민성 신경세포의 기능이상을 유발시킨다고 보고하였다[58].
본 연구에서 immunoblotting과 IHC를 통해 선조체 내 TH의 발현량을 분석한 결과, MPTP-C 집단이 CON 집단에 비해 통계적으로 유의하게 감소하였으나 ME 집단은 통계적으로 유의하게 증가하였다. 이 결과는 18주의 트레드밀 운동을 처치한 Lau et al. [40]의 결과와 일치하며, 트레드밀 운동이 선조체 내 감소된 TH를 회복시키는데 상당한 효과를 제시한 것으로 생각된다.
PD의 초기 증상개선에 사용되는 대표적인 약물은 도파민 전구물질인 L-DOPA로써 부족한 도파민을 보충하기 위해 투여되지만 장기투여 시 부작용이 존재한다고 보고된다[59]. 따라서 트레드밀 운동이 TH의 발현을 증가시켜 선조체 내 L-DOPA의 수준과 도파민 수준에 어떤 영향을 미치는지 후속 연구를 통해 밝혀낼 필요가 있겠다.
Biomarker로써 질병제어를 위한 miRNA에 대한 연구가 활발히 진행되고 있는 가운데 miRNA의 delivery에 대한 명확한 해답이 없는 실정에서 본 연구는 처음으로 MPTP로 유도한 PD 모델의 선조체 내 miR-153, SNCA mRNA와 α-synuclein의 발현량 및 운동과의 관련성을 제시하였다. 본 연구 결과, 트레드밀 운동은 단백질로의 번역 전 과정에 영향을 미쳐 α-synuclein 발현 수준을 감소시키고, 감소된 TH의 발현 수준을 증가시켜 PD의 병리적 특징을 개선시켰다. 따라서 운동처치와 miRNA의 발현 변화가 질환에 미치는 영향을 살펴보는 것은 비약물적 치료 방법으로서 지속적인 연구가 필요하다고 생각된다.